Profilaktyka i leczenie
Prospektywne, obserwacyjne badanie obejmujące 223 128 osób, przeprowadzone na terenie całego miasta z zastosowaniem metody Propensity Score Matching (statystycznego wpływu netto zmiennej niezależnej na zmienną zależną) wykazało, że zastosowanie iwermektyny wiązało się z istotnym zmniejszeniem liczby zakażeń COVID-19, hospitalizacji i zgonów z powodu COVID-19.
Prospektywne, obserwacyjne badanie obejmujące 223 128 osób, przeprowadzone na terenie całego miasta z zastosowaniem metody Propensity Score Matching (statystycznego wpływu netto zmiennej niezależnej na zmienną zależną).
Autorzy: Lucy Kerr, Flavio A. Cadegiani, Fernando Baldi, Raysildo B. Lobo, Washington Luiz O. Assagra, Fernando Carlos Proença, Pierre Kory, Jennifer A. Hibberd, Juan J. Chamie-Quintero
Opublikowano: 15 stycznia 2022, DOI: 10.7759/cureus.21272
W pracy zacytowano publikacje: Kerr L, Cadegiani F A, Baldi F, i inni (15 stycznia, 2022) Profilaktyka iwermektyną stosowana w badaniu COVID-19: Prospektywne, obserwacyjne badanie obejmujące 223 128 osób, przeprowadzone na terenie całego miasta z zastosowaniem metody Propensity Score Matching w Cureus 14(1): e21272. doi:10.7759/cureus.21272.
Streszczenie:
Wprowadzenie: Iwermektyna wykazała różne mechanizmy działania, które potencjalnie chronią zarówno przed zakażeniem koronawirusem 2019 (COVID-19), jak i chorobami współistniejącymi związanymi z COVID-19. W oparciu o badania sugerujące skuteczność w profilaktyce w połączeniu ze znanym profilem bezpieczeństwa iwermektyny, w Itajaí, południowym mieście w Brazylii w stanie Santa Catarina, wdrożono ogólnomiejski program profilaktyczny z zastosowaniem iwermektyny dla COVID-19. Celem pracy była ocena wpływu regularnego stosowania iwermektyny na późniejsze zakażenia COVID-19 i śmiertelność.
Materiały i metody: Przeanalizowaliśmy dane z prospektywnego, obserwacyjnego badania ogólnomiejskiego programu profilaktyki COVID-19 za pomocą iwermektyny, które było prowadzone od lipca 2020 do grudnia 2020 roku w Itajaí w Brazylii. Projekt badania, zatwierdzenie instytucjonalnej komisji rewizyjnej i analiza danych rejestrowych nastąpiły po zakończeniu programu. Program polegał na zaproszeniu całej populacji Itajaí na wizytę lekarską w celu zapisania się do programu i zebrania informacji wyjściowych, osobistych, demograficznych i medycznych. W przypadku braku przeciwwskazań, iwermektyna była oferowana pacjentom jako opcjonalne leczenie, które miało być stosowane przez dwa kolejne dni co 15 dni w dawce 0,2 mg/kg/dzień. W przypadkach, gdy uczestniczący w projekcie mieszkaniec Itajaí zachorował na COVID-19, zalecono mu, aby nie stosował iwermektyny ani żadnych innych leków w ramach wczesnego leczenia ambulatoryjnego. Kliniczne wyniki infekcji, hospitalizacji i śmierci były automatycznie raportowane i wprowadzane do rejestru w czasie rzeczywistym. Analiza badania polegała na porównaniu pacjentów stosujących iwermektynę z pacjentami niestosującymi tej substancji w kohortach pacjentów zakażonych, dopasowanych pod względem wieku, płci i chorób współistniejących. Wskaźniki infekcji i śmiertelności COVID-19 analizowano z zastosowaniem i bez zastosowania metody Propensity Score Matching (PSM) - (statystycznego wpływu netto zmiennej niezależnej na zmienną zależną - przyp. tłum.).
Wyniki: Spośród 223 128 mieszkańców Itajaí uwzględnionych w badaniu, do analizy uwzględniono łącznie 159 561 osób: 113 845 (71,3%) regularnie stosujących iwermektynę i 45 716 (23,3%) nie stosujących. Spośród nich zakażeniu uległo 4 311 osób stosujących iwermektynę, wśród których 4 197 pochodziło z miasta Itajaí (wskaźnik zakażeń 3,7%), a zakażeniu uległo 3 034 osób nie stosujących iwermektyny (z Itajaí) (wskaźnik zakażeń 6,6%), przy czym wskaźnik zakażeń COVID-19 zmniejszył się o 44% (wskaźnik ryzyka [RR], 0,56; 95% przedział ufności (95% CI), 0,53-0,58; p < 0,0001). Za pomocą PSM porównano dwie kohorty 3 034 osób zakażonych wirusem COVID-19. Regularne stosowanie iwermektyny prowadziło do 68% redukcji śmiertelności z powodu COVID-19 (25 [0,8%] wobec 79 [2,6%] wśród osób nie stosujących iwermektyny; RR, 0,32; 95% CI, 0,20-0,49; p < 0,0001). Po skorygowaniu o zmienne resztkowe, redukcja śmiertelności wyniosła 70% (RR, 0,30; 95% CI, 0,19-0,46; p < 0,0001). Odnotowano 56% redukcję częstości hospitalizacji (44 versus 99 hospitalizacji odpowiednio wśród osób stosujących iwermektynę i nie stosujących; RR, 0,44; 95% CI, 0,31-0,63; p < 0,0001). Po skorygowaniu o zmienne resztkowe, redukcja częstości hospitalizacji wyniosła 67% (RR, 0,33; 95% CI, 023-0,66; p < 0,0001).
Wnioski: W tym dużym badaniu PSM regularne stosowanie iwermektyny jako środka profilaktycznego wiązało się z istotnie mniejszą liczbą zakażeń COVID-19, hospitalizacji i śmiertelności.
Wstęp
W toku badań klinicznych wykazano, że iwermektyna ma nie tylko szerokie działanie przeciwpasożytnicze1, 2, ale także przeciwwirusowe, przeciwbakteryjne i przeciwpierwotniakowe. Iwermektyna jest od dawna proponowana do stosowania jako środek przeciwwirusowy o zmienionym przeznaczeniu3-6. Rzeczywiście, odnotowano przeciwwirusowe działanie iwermektyny zarówno wobec wirusów typu RNA, jak i DNA, w tym HIV-1, żółtej febry, japońskiego zapalenia mózgu, kleszczowego zapalenia mózgu, gorączki Zachodniego Nilu, Zika, dengi, chikungunya, wenezuelskiego końskiego zapalenia mózgu i wirusa pseudorabies 3, 5, 7, 8, jak również stwierdzono jej działanie w regulacji białek zaangażowanych w odpowiedzi przeciwwirusowej.8
Dodatkowe opisane działania iwermektyny obejmują ponadto aktywność agonistyczną wobec receptora wątrobowego X (LXR) i receptora farnezoidowego X (FXR), z wieloma potencjalnymi korzyściami metabolicznymi9,10; regenerację neuronów11, 12, zapobieganie niedotlenieniu mięśni13, oraz działanie na specyficzne miejsca, w tym interferon (INF)14, czynnik jądrowy-κB (NF-κB), lipopolisacharyd (LPS)15, oraz szlak kinazy Janusa/ transduktora sygnału i aktywatora transkrypcji (JAK-STAT) i PAI-116, 17; wytwarzanie aktywowanej przez P21 kinazy 1 (PAK-1)18, 19; obniżenie poziomu interleukiny-6 (IL-6)15; modulację allosteryczną receptora P2X420; hamowanie High Mobility Group Box 1 (HMGB1)21,22; oraz hamowanie hipersekrecji śluzu, zmniejszanie rekrutacji komórek odpornościowych i produkcji cytokin w płucach23. Opisano również, że iwermektyna indukuje odpowiedź immunologiczną typu komórek T helper 1 (Th1) przeciwko zakażeniom pierwotniakami24 oraz działanie przeciwzakrzepowe poprzez wiązanie się z białkiem S niektórych wirusów25.
Za hipotezą, że iwermektyna może działać ochronnie przeciwko chorobie koronawirusowej 2019 (COVID-19) przemawia jej wielościeżkowe, przeciwzapalne działanie15, 26 oraz wieloprzeciwwirusowe mechanizmy. Patogeneza COVID-19 jest w dużej mierze rozumiana jako infekcja hemaglutynacyjna o podłożu zapalnym, zaburzająca układ płucny, naczyniowy i śródbłonkowy, co prowadzi do choroby wieloukładowej. In vitro i in silico, iwermektyna wykazała aktywność przeciw koronawirusowi typu drugiego zespołu ostrej niewydolności oddechowej (SARS-CoV-2 - przyp. tłum.) poprzez ponad 20 bezpośrednich i pośrednich mechanizmów2, 27, 28.
Iwermektyna wykazała wstępne działanie ochronne przed zakażeniem koronawirusem 2 (SARS-CoV-2) w odniesieniu do skrócenia czasu do wyzdrowienia klinicznego oraz wskaźników progresji choroby i śmiertelności2, 29, 30. Nadal jednak zalecane są bardziej solidne badania z większą liczbą prób, aby potwierdzić ewentualne korzystne działanie iwermektyny w badaniu COVID-19.
Od początku pandemii COVID-19, stosowanie niedrogich opcji opartych na konsekwentnie korzystnym sygnale skuteczności, dobrze ustalonym profilu bezpieczeństwa i korzystnej efektywności kosztowej, iwermektyna jest bardzo atrakcyjną interwencją dla medycyny skoncentrowanej na pacjencie, praktykowanej przez klinicystów pierwszego kontaktu, a jej stosowanie jest zgodne z bioetycznymi zasadami praktyki medycznej przedstawionymi w artykule 36 Deklaracji Helsińskiej.31
Jednakże, pomimo tak korzystnego profilu ryzyka/korzyści i braku alternatywy terapeutycznej, iwermektyna nie została jeszcze zatwierdzona do profilaktyki i leczenia COVID-19 przez agencje na całym świecie, w tym FDA (USA), Europejską Agencję Leków (EMA; Europa) i ANVISA (Agência Nacional de Vigilância Sanitária - Brazylijska Agencja Regulacji Zdrowia; Brazylia).
Możliwość przepisywania iwermektynie lub innemu lekowi spoza listy w przypadku COVID-19 od dawna zależy od uznania lekarzy pierwszego kontaktu, po ujawnieniu wszystkich zagrożeń, niepewności, potencjalnych korzyści i praw pacjentów oraz uzyskaniu świadomej zgody. Na szczególną uwagę zasługuje fakt, że w Brazylii jest to zgodne z autonomią lekarską w zakresie określania najlepszych strategii terapeutycznych dla poszczególnych osób, zgodnie z Kodeksem Etyki Lekarskiej Brazylijskiej Rady Lekarzy, Federalnej Rady Medycyny - Conselho Federal de Medicina (CFM), który określa obowiązki i prawa lekarzy w Brazylii32.
Ponieważ szczepionki przeciwko COVID-19 nie (były) dostępne w Brazylii do 2021 roku, a także z powodu braku alternatywnych rozwiązań profilaktycznych w przypadku braku szczepionek, Itajaí, miasto w południowym brazylijskim stanie Santa Catarina, zainicjowało ogólnospołeczny rządowy program profilaktyki COVID-19. Ustalone parametry decyzyjne o charakterze medycznym opierają się na dystrybucji iwermektyny dla całych populacji w różnych krajach. Aby zapewnić bezpieczeństwo populacji, opracowano dobrze kontrolowany program komputerowy do kompilacji i przechowywania wszystkich istotnych danych demograficznych i klinicznych (szczegółowo opisanych w rozdziale Materiały i Metody). Stosowanie iwermektyny było opcjonalne i opierało się na preferencjach pacjentów, ponieważ jej korzyści jako środka zapobiegawczego nie zostały udowodnione.
Celem tego badania jest ocena wpływu na ważne wyniki kliniczne stosowania iwermektyny jako profilaktyki w przypadku COVID-19. Program profilaktyki był realizowany jako dodatek do standardowych strategii niefarmakologicznych, takich jak maskowanie i dystans społeczny, w ramach ogólnomiejskiego programu prowadzonego w warunkach ambulatoryjnych.
Materiały i metody
Badana populacja
Było to prospektywne badanie obserwacyjne. Chociaż projekt badania, zatwierdzenie przez Radę ds. Przeglądu Instytucjonalnego (IRB) i analiza danych miały miejsce po zakończeniu dobrowolnego programu profilaktyki, wszystkie dane były gromadzone prospektywnie w czasie rzeczywistym z obowiązkowym zgłaszaniem do rejestru wszystkich zdarzeń, które wystąpiły podczas ogólnomiejskiego rządowego programu profilaktyki COVID-19 z zastosowaniem iwermektyny, od lipca 2020 roku do grudnia 2020 roku, prowadzonego w mieście Itajaí, w stanie Santa Catarina w Brazylii. Dane demograficzne i kliniczne pochodziły z dokumentacji medycznej pacjentów obserwowanych w dużej placówce ambulatoryjnej (tymczasowa przychodnia utworzona w Centrum Kongresowym Itajaí) i kilku drugorzędnych placówkach ambulatoryjnych, w ramach powszechnego systemu opieki zdrowotnej (Sistema Único de Saúde [SUS]).
Celem badań było określenie liczby pacjentów zarażonych wirusem SARS-CoV-2 (wskaźnik pozytywności reakcji łańcuchowej odwrotnej transkrypcji-polimerazy [RT-PCR] dla SARS-CoV-2), ryzyka zgonu z powodu COVID-19 (zarażonych lub niezarażonych) oraz wskaźnika śmiertelności z powodu COVID-19 (ryzyko zgonu z powodu COVID-19) wśród osób, które stosowały i nie stosowały iwermektyny profilaktycznie dla COVID-19. Dane te były stratyfikowane według wieku, płci, obecności chorób współistniejących i skorelowanych cech demograficznych.
Niniejsza retrospektywna analiza prospektywnie zebranych danych została zatwierdzona przez Krajową Radę Etyki Badań Naukowych (CONEP) pod numerem 4.821.082 z numerem projektu CAAE: 47124221.2.0000.5485. Chociaż projekt badania, zatwierdzenie IRB i analiza danych miały miejsce po zakończeniu dobrowolnego programu profilaktyki, wszystkie dane były gromadzone prospektywnie w czasie rzeczywistym z obowiązkowym raportowaniem do rejestru wszystkich zdarzeń, które wystąpiły podczas ogólnomiejskiego rządowego programu profilaktyki COVID-19 z iwermektyną, od 7 lipca 2020 roku do 2 grudnia 2020 roku, opracowanego w mieście Itajaí, w stanie Santa Catarina, Brazylia.
Procedury badania i gromadzenie danych
Opcjonalne, dobrowolne profilaktyczne stosowanie iwermektyny oferowano pacjentom podczas regularnych wizyt lekarskich między 7 lipca 2020 r. a 2 grudnia 2020 r., W 35 różnych miejscach, w tym 34 lokalnych ośrodkach zdrowia SUS i dużym tymczasowym ustawieniu pacjentów 24/7. Lekarze pracujący w tych miejscach mieli swobodę w przepisywaniu iwermektyny profilaktycznie. Uczestnicy badania, którzy nie stosowali iwermektyny, albo odmówili, albo ich lekarze podstawowej opieki zdrowotnej zdecydowali się nie oferować iwermektyny.
Aby uniknąć zaniżonych danych, przestrzegano ścisłej sekwencji procedur:
1) rejestracja i zapisywanie danych pacjentów, udokumentowane przez asystentów;
2) ważenie uczestników (waga uczestnika była niezbędna do obliczenia odpowiedniej dawki iwermektyny);
3) krótka ocena medyczna dotycząca przeszłości medycznej, chorób współistniejących, stosowania leków i przeciwwskazań do stosowania leków; oraz
4) recepta lekarska z profilaktycznymi dawkami iwermektyny (w ramach zalecanych zwykłych, bezpiecznych dawek iwermektyny), zgodnie z oceną medyczną i po uzyskaniu świadomej zgody uczestnika związanej z potencjalnymi korzyściami, ryzykiem i działaniami niepożądanymi.
Wszystkie szczegóły tego ogólnomiejskiego programu i kampanii zostały wcześniej uzgodnione między miejskim lokalnym wydziałem Narodowego Systemu Ochrony Zdrowia (SUS), burmistrzem miasta i lokalnymi prokuratorami.
Jeśli chodzi o interakcje lekowe z iwermektyną, stosowanie warfaryny było przeciwwskazaniem do profilaktyki iwermektyną z powodu interakcji lekowych. Osobom przewlekle stosującym glikokortykoidy, inhibitory proteazy i leki przeciwpadaczkowe zalecono regularne wizyty lekarskie co 6-8 tygodni. Zalecono, aby badani informowali lekarzy o stosowaniu iwermektyny w przypadku, gdy przepisano im jeden lub więcej z następujących leków: warfaryna, azytromycyna, deksametazon, prednizon lub prednizolon (hydrokortyzon lub kortyzon nie są dostępne w regularnych aptekach w Brazylii).
Analizie poddano następujące zmienne:
1) wiek,
2) płeć,
3) wcześniejsze choroby (zawał serca [MI] i udar mózgu),
4) wcześniej istniejące choroby współistniejące (cukrzyca typu 2 [T2D], astma, przewlekła obturacyjna choroba płuc [POChP], nadciśnienie tętnicze, dyslipidemia, choroby sercowo-naczyniowe [CVD], rak [dowolny typ] i inne choroby płuc) oraz
5) palenie tytoniu. Zmienne zostały skorygowane jako czynniki zakłócające i użyte jako zmienne do równoważenia i dopasowania grup dla propensity score matching (PSM).
Pacjenci, u których wystąpiły objawy lub rozpoznanie COVID-19 przed 7 lipca 2020 r., zostali wykluczeni z próby. Innymi kryteriami wykluczenia były przeciwwskazania do stosowania iwermektyny i osoby w wieku poniżej 18 lat. Dawka i częstotliwość leczenia iwermektyną wynosiła 0,2 mg/kg/dzień, tj. podawanie jednej tabletki 6 mg na każde 30 kg przez dwa kolejne dni co 15 dni.
W trakcie badania uczestnicy, u których rozpoznano COVID-19, przechodzili specjalną wizytę lekarską w celu oceny objawów klinicznych i nasilenia COVID-19. Wszystkim badanym zalecono, aby nie stosowali iwermektyny, nitazoksanidu, hydroksychlorochiny, spironolaktonu ani żadnego innego leku, który miałby być skuteczny w walce z COVID-19. Miasto nie zapewniało ani nie popierało żadnego specyficznego farmakologicznego leczenia ambulatoryjnego dla osób zakażonych COVID-19. Byli oni pytani o obecność typowych objawów COVID-19. Obejmowały one dreszcze, gorączkę wysokiego stopnia, kaszel, mialgię, zmęczenie, anosmię, ageusię, ból gardła, ból głowy, zatkany nos, kichanie, katar, krwioplucie, nudności, wymioty, ból brzucha, biegunkę, wysypkę skórną, artralgię, ból w klatce piersiowej, ból oczu i różowe oczy oraz obecność objawów alarmowych, w tym duszności, objawów hipoksji, objawów zaburzeń krzepnięcia i zmienionego poziomu świadomości. Mierzono skurczowe i rozkurczowe ciśnienie krwi, częstość akcji serca, częstość oddechów, saturację tlenem i temperaturę pachową. Te same oznaki i objawy oraz parametry życiowe były zbierane podczas każdej następnej wizyty lekarskiej podczas badania COVID-19. Poszczególne dane zostały zebrane i przejrzane przez badaczy.
Dokonano przeglądu danych rejestrowych wszystkich pacjentów z miasta Itajaí w okresie od 7 lipca 2020 r. do 2 grudnia 2020 r., w tym tych, którzy stosowali iwermektynę i tych, którzy jej nie stosowali. Wszystkie osoby, u których stwierdzono dodatni wynik testu na obecność COVID-19 w mieście Itajaí podczas badania, zostały uwzględnione w tej analizie. Spośród zakażonych osób uwzględniono dwie grupy: osoby, które stosowały profilaktycznie iwermektynę (grupa leczona) i osoby, które nie stosowały profilaktycznie iwermektyny (grupa nieleczona). Brakujące dane od pacjentów zostały wyjaśnione z pacjentami lub krewnymi bezpośrednio, telefonicznie lub osobiście, przez badaczy. Ponieważ jest to program ogólnomiejski, wszystkie zarejestrowane dane musiały być zgodne z dokładną liczbą przypadków i zgonów COVID-19 w mieście. Ten ścisły przedział pozwala uniknąć różnic w zakresie okresów ekspozycji.
Ze względu na niepewność ponownego zakażenia wirusem COVID-19, osoby z historią wcześniejszego zachorowania na COVID-19 nie uczestniczyły w programie, chociaż nadal mogły stosować profilaktycznie iwermektynę. Ograniczające parametry systemu rządowego pozwalały na rejestrację tylko pierwszego epizodu zakażenia COVID-19. Osoby w wieku poniżej 18 lat i osoby z rozpoznaniem COVID-19 przed 7 lipca 2020 r. zostały wykluczone ze wszystkich zbiorów danych i analiz.
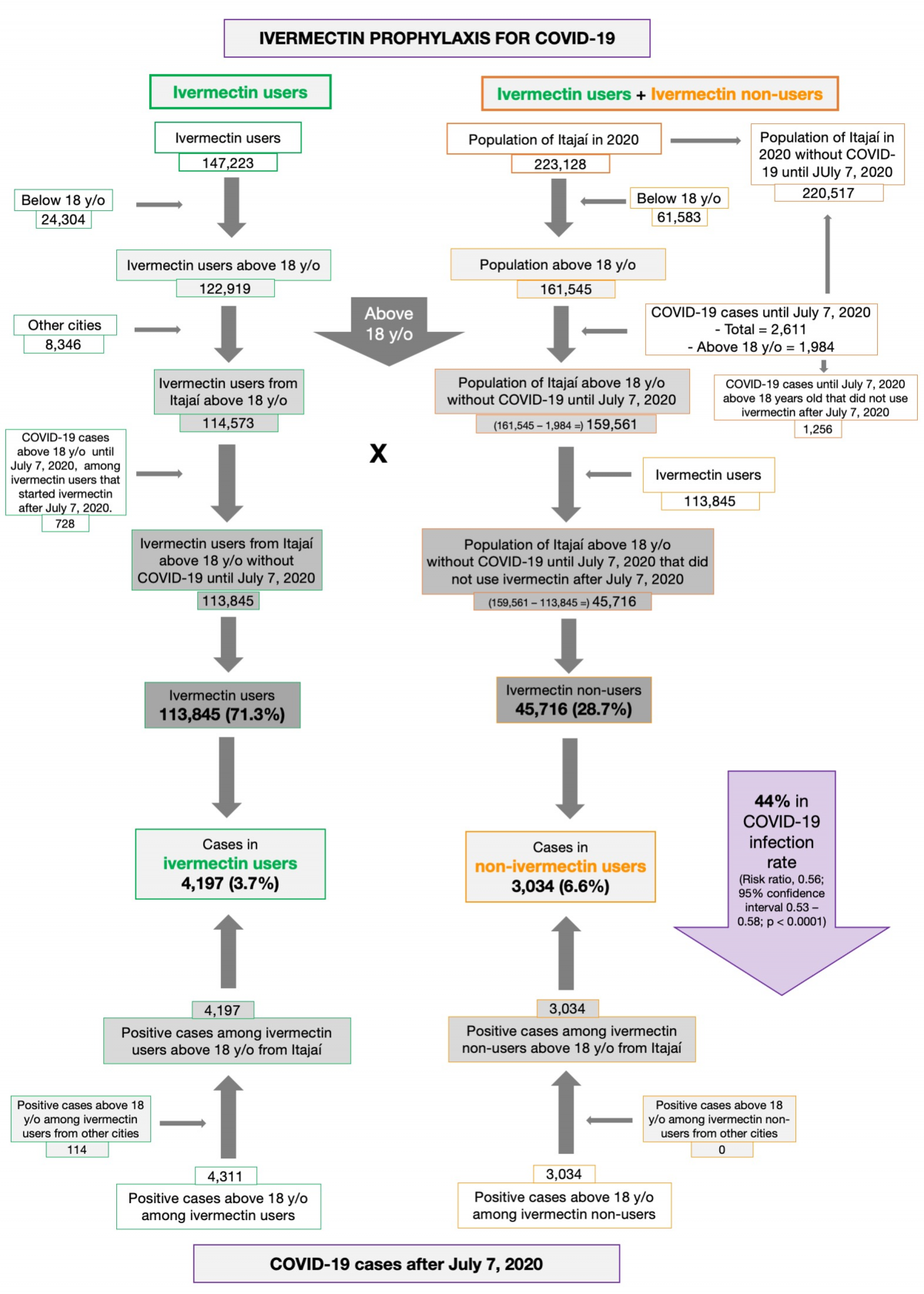
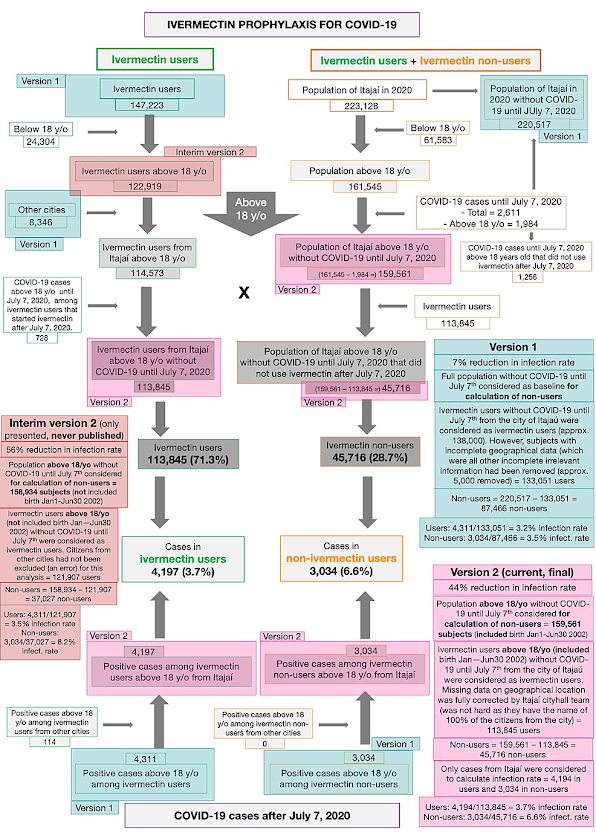
Z rejestru populacji miasta (223 128 mieszkańców) usunięto osoby poniżej 18 roku życia (61 583 osoby). Z 161 545 uczestników powyżej 18 roku życia z miasta Itajaí usunęliśmy 1 984 przypadki COVID-19, które wystąpiły przed 7 lipca 2020 r., Pozostało 159 561 uczestników. Za osoby powyżej 18 roku życia uznano tych, którzy urodzili się przed 30 czerwca 2002 r.
W programie profilaktyki iwermektynowej stosowanej w COVID-19 uczestniczyło łącznie 147 223 osób. Spośród nich, 24 304 uczestników było w wieku poniżej 18 lat. Spośród 122 919 osób stosujących iwermektynę w wieku powyżej 18 lat, 8 346 pochodziło z innych miast, a 728 miało COVID-19 przed 7 lipca 2020 r., chociaż stosowało iwermektynę po tym terminie. W sumie 113 845 osób, które uczestniczyły w programie, pozostało w zbiorze danych. 45 716 osób nieuczestniczących w programie, pozostałych wśród 159 561 uczestników, uznano za osoby nieużywające iwermektyny.
Wreszcie, ogólnomiejskie wskaźniki hospitalizacji i śmiertelności z powodu COVID-19 w Itajaí zostały porównane pomiędzy okresem przed programem (przed 7 lipca 2020) i w trakcie programu (pomiędzy 7 lipca 2020 a 2 grudnia 2020) w celu oceny, czy program profilaktyki iwermektyną dla COVID-19 miałby pozytywny wpływ na ogólne liczby w mieście, pomimo tylko częściowego przyjęcia. Szanse zgonu z powodu COVID-19 w ogólnej populacji, w zależności od stosowania lub niestosowania iwermektyny (niezależnie od zakażenia COVID-19), obliczono tylko przed dopasowaniem. I odwrotnie, śmiertelność wśród osób zakażonych SARS-CoV-2 obliczono zarówno dla kohorty przed, jak i po dopasowaniu.
Współczynniki hospitalizacji i śmiertelności przed dopasowaniem grup, współczynnik śmiertelności w subpopulacjach przed i po PSM oraz lista kontrolna Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) są przedstawione w Dodatku.
Analiza statystyczna
Pełne dane stanowiące podstawę niniejszej analizy zostały przeanalizowane przez dwóch niezależnych statystyków, a rozbieżności zostały ocenione przez trzeciego eksperta w dziedzinie statystyki. W tym badaniu ambulatoryjnym osób, które uzyskały pozytywny wynik testu na obecność SARS-CoV-2, śmiertelność oceniano w zależności od każdego parametru, który był skorygowany względem innych zmiennych (do analizy regresji wieloczynnikowej) i używany do równoważenia i dopasowywania grup, w tym przedziałów wiekowych, płci, historii palenia tytoniu, profilaktycznego stosowania iwermektyny, T2D, astmy, POChP, chorób sercowo-naczyniowych i innych chorób płuc, nadciśnienia tętniczego, aktualnego nowotworu (dowolnego typu) i historii udaru mózgu i /lub zawał mięśnia sercowego.
Przed dopasowaniem zastosowano uogólniony liniowy model mieszany, zakładając rozkład dwumianowy dla reszt i włączając stałe efekty klasyfikacyjne każdego z tych parametrów. Przedziały wiekowe zostały dostosowane do oceny profilaktycznego stosowania iwermektyny jako niezależnego predyktora zgonu z COVID-19. Podano nieskorygowane i wieloczynnikowe prawdopodobieństwa przeżycia z powodu COVID-19 skorygowane metodą Poissona (p-value), w zależności od każdego parametru.
Oszacoanie ryzyka przeprowadzono dla ryzyka śmiertelności pomiędzy osobami stosującymi iwermektynę i nie stosującymi tej metody. Współczynnik zakażenia COVID-19 i ryzyko zgonu obliczono również dla zmiennych. Po PSM przeprowadzono drugą korektę ("double adjustment") za pomocą wieloczynnikowej regresji liniowej dla zmiennych resztkowych33,34.
Brakujących danych nie było, gdyż konstrukcja systemu rejestru nakazywała wypełnienie wszystkich zmiennych danych, aby formalnie zostać włączonym do rejestru. Stwierdzono jedynie błędnie wprowadzone (nielogiczne) dane. W takich przypadkach dokonywano przeglądu dokumentacji medycznej w celu uzyskania dokładnych danych. Programem użytym do analizy był Statistical Analysis Software (SAS/STAT) (SAS Institute Inc., Cary, NC). Ze względu na przejrzystość, dwa zbiory danych 7 345 przypadków COVID-19 i 113 845 uczestniczących osób uwzględnionych w niniejszej analizie zostaną upublicznione po opublikowaniu recenzowanej publikacji.
Wyniki
Szczegółowy opis danych uwzględnionych w niniejszej analizie przedstawiono na rycinie 1. Spośród 220 517 mieszkańców Itajaí bez COVID-19 do 7 lipca 2020 r., 159 561 było w wieku powyżej 18 lat. Spośród 159 561 obywateli w wieku powyżej 18 lat bez COVID-19 do 7 lipca 2020 r., 113 845 (71,3% populacji w wieku powyżej 18 lat) otrzymało iwermektynę przed zakażeniem przez COVID-19. Łącznie 45 716 obywateli (28,7%) nie otrzymało lub nie chciało otrzymać iwermektyny w trakcie trwania programu, w tym profilaktycznie lub jako leczenie po przebyciu COVID-19.
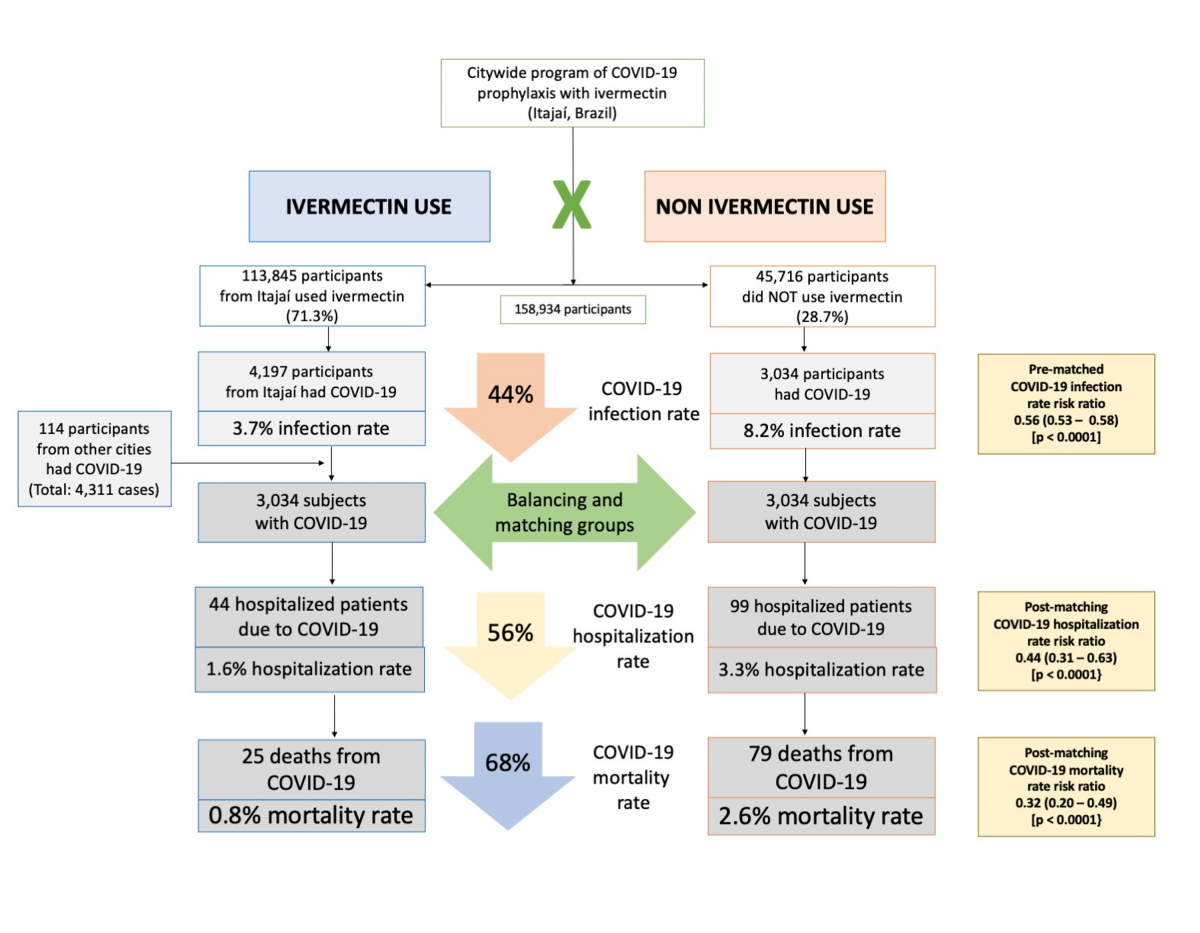
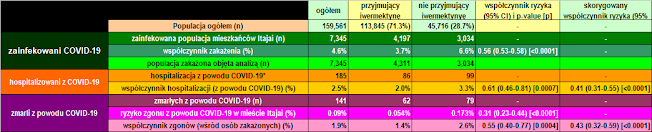
| Ryc. 1: Podstawowe dane z badania dotyczącego profilaktyki iwermektyną wykorzystanego w badaniu COVID-19. |
Spośród 113 845 profilaktycznie leczonych osób z miasta Itajaí, 4 197 miało pozytywny wynik RT-PCR SARS-CoV-2 (3,7% wskaźnik zakażenia), podczas gdy 3 034 z 37 027 nieleczonych osób miało pozytywny wynik RT-PCR SARS-CoV-2 (6,6% wskaźnik zakażenia), co stanowi 44% zmniejszenie wskaźnika zakażenia COVID-19 (współczynnik ryzyka [RR], 0,56; 95% przedział ufności (95% CI), 0,53-0,58; p < 0,0001). Dodatkowo 114 osób, które stosowały iwermektynę i zostały zakażone, pochodziło z innych miast, ale zostały zarejestrowane w ramach programu, co w sumie daje 4 311 pozytywnych przypadków wśród osób stosujących iwermektynę. Do obecnej analizy wzięto pod uwagę 4 311 pozytywnych przypadków wśród osób, które stosowały iwermektynę i 3 034 przypadków wśród osób, które nie stosowały iwermektyny. Po PSM utworzono dwie kohorty 3,034 uczestników.
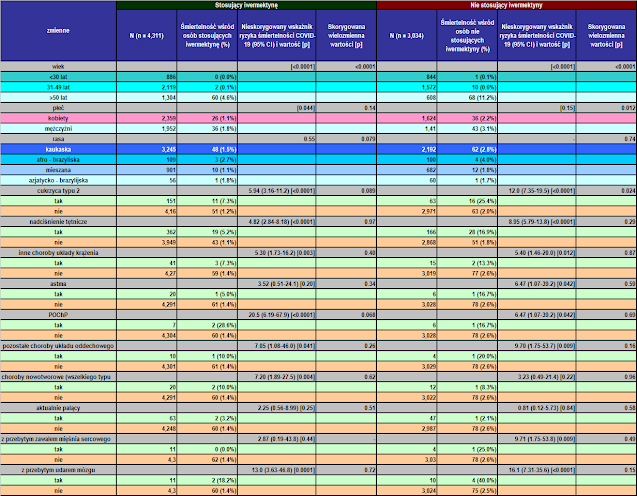
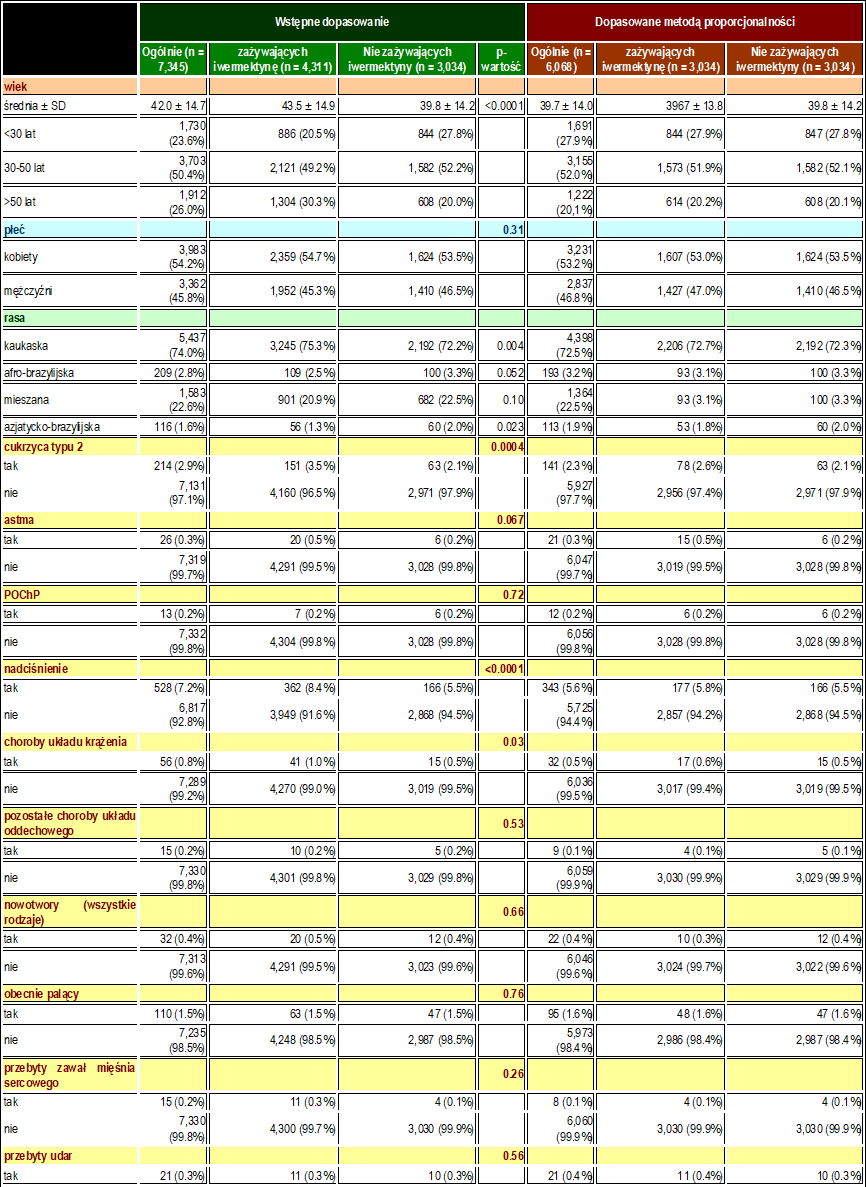
Charakterystyka linii podstawowej 7 345 uczestników włączonych przed PSM i charakterystyka linii podstawowej 6 068 uczestników w dopasowanych grupach są przedstawione w Tabeli 1. Przed PSM osoby stosujące iwermektynę miały wyższy odsetek osób w wieku powyżej 50 lat (p < 0,0001), wyższą częstość występowania T2D (p = 0,0004), nadciśnienia tętniczego (p < 0,0001) i CVD (p = 0,03) oraz wyższy odsetek osób rasy kaukaskiej (p = 0,004) niż osoby niestosujące iwermektyny. Po PSM wszystkie parametry wyjściowe były podobne między grupami. Rycina 2 podsumowuje główne wyniki tego badania.
|
Tabela 1: Charakterystyka wyjściowa osób włączonych do badania przed dopasowaniem i po dopasowaniu propensity score.
|
|
Ryc. 2: Podsumowanie wyników badań:
|
Wskaźniki hospitalizacji i śmiertelności u osób stosujących iwermektynę i nie stosujących jej w analizie propensity score-matched (analiza propensity score-matched).
Jak opisano w Tabeli 2, po zastosowaniu PSM, spośród 6 068 badanych (3 034 w każdej grupie), odnotowano 44 hospitalizacje wśród osób stosujących iwermektynę (1,6% wskaźnik hospitalizacji) i 99 hospitalizacji (3,6% wskaźnik hospitalizacji). 44 hospitalizacje wśród osób stosujących iwermektynę (1,6% wskaźnik hospitalizacji) i 99 hospitalizacji (3,3% wskaźnik hospitalizacji) wśród osób stosujących iwermektynę. Wśród osób nie stosujących iwermektyny, co stanowi 56% zmniejszenie częstości hospitalizacji (RR, 0,44; 95% CI, 0.31-0.63). Po skorygowaniu o zmienne, redukcja częstości hospitalizacji wyniosła 67% (RR, 0,33; 95% CI, 023-0,66; p < 0,0001).
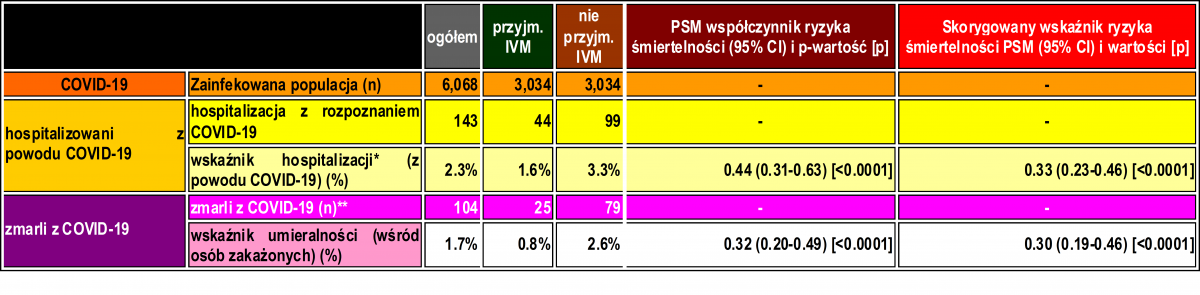
Odnotowano 25 zgonów wśród osób stosujących iwermektynę (śmiertelność 0,8%) i 79 zgonów wśród osób nie stosujących iwermektyny (śmiertelność 2,6%), co oznacza zmniejszenie śmiertelności o 68% (RR, 0,32; 95% CI, 0,20-0,49). Po skorygowaniu PSM redukcja śmiertelności wyniosła 70% (RR, 0,30; 95% CI, 0,19-0,46; p < 0,0001).
Determinanty śmiertelności w grupie COVID-19 w analizie propensity score-matched
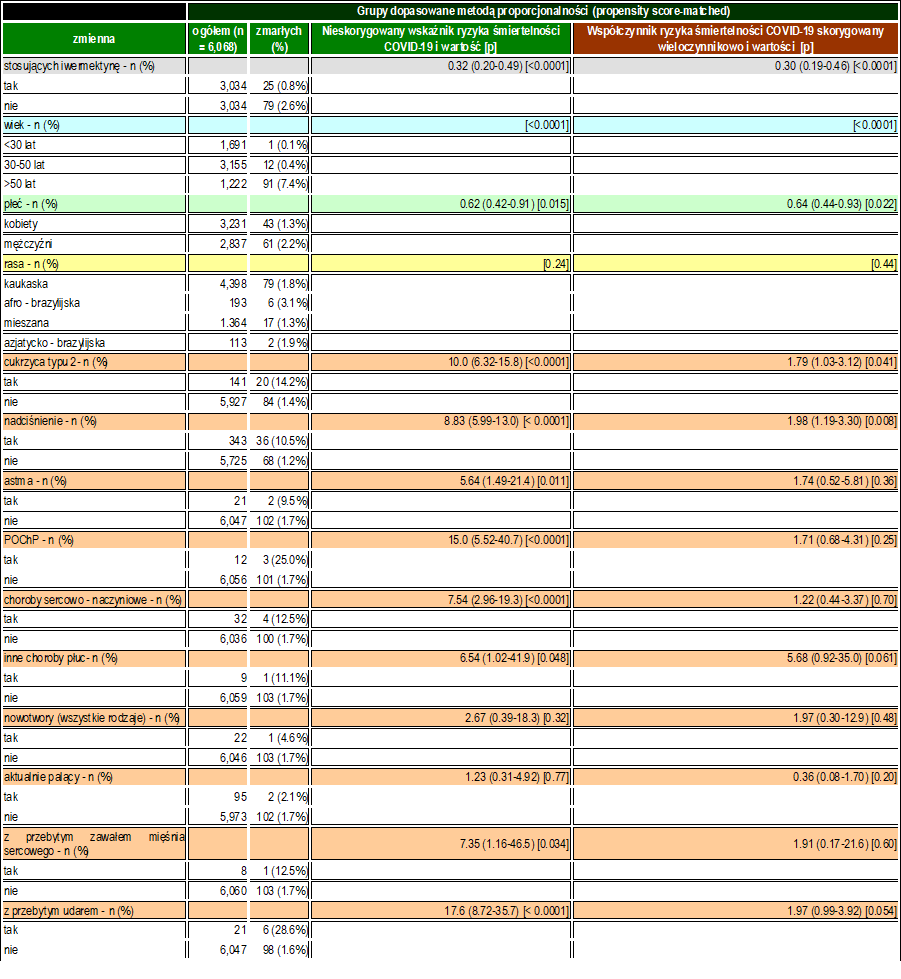
W tabeli 3 opisano wynikowe czynniki ryzyka zgonu z powodu COVID-19 wśród całej populacji za pomocą analizy PSM. Czynniki ryzyka śmiertelności w COVID-19 obejmowały starzenie się (p < 0,0001), płeć męską (p = 0,015), T2D (p < 0,0001), nadciśnienie tętnicze (p < 0,0001), astmę (p = 0,011), POChP (p < 0,0001), inne choroby płuc (p = 0,048), przebyty zawał serca (p = 0,034) i udar mózgu (p < 0,0001). W celu wykrycia niezależnych czynników ryzyka, dostosowanie zmiennych post-PSM wykazało, że iwermektyna (p < 0,0001; zmniejszenie ryzyka śmiertelności o 70%) i płeć żeńska (p = 0,022; zmniejszenie ryzyka śmiertelności o 38%) były czynnikami chroniącymi, podczas gdy T2D (p = 0. 041; 79% wzrost ryzyka śmiertelności), nadciśnienie tętnicze (p = 0,008; 98% wzrost ryzyka śmiertelności) oraz marginalnie inne choroby płuc (p = 0,061; 468% wzrost ryzyka śmiertelności) i udar mózgu w wywiadzie (p = 0,054; 97% wzrost ryzyka śmiertelności) zostały zidentyfikowane jako niezależne czynniki ryzyka.
| Tabela 3: Dopasowany metodą proporcjonalności wskaźnik śmiertelności COVID-19 według każdej cechy w populacji ogólnej, osób stosujących iwermektynę i osób niestosujących. |
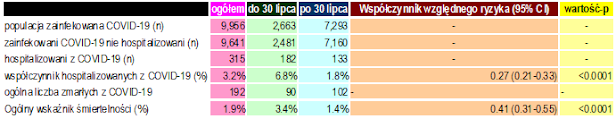
W porównaniu ogólnomiejskich wskaźników hospitalizacji COVID-19 przed rozpoczęciem programu i w trakcie jego trwania, śmiertelność COVID-19 zmniejszyła się z 6,8% przed rozpoczęciem programu z profilaktycznym stosowaniem iwermektyny, do 1,8% po jego rozpoczęciu (RR, 0,27; 95% CI, 0,21-0,33; p < 0,0001), a śmiertelność COVID-19 z 3,4% do 1,4% (RR, 0,41; 95% CI, 0,31-0,55; p < 0,0001) (tab. 4).
Dyskusja
Przedstawiony powyżej prospektywny, ogólnomiejski program profilaktyki COVID-19 z zastosowaniem iwermektyny spowodował znaczące zmniejszenie liczby zakażeń COVID-19, a także hospitalizacji i zgonów. W analizie całej populacji stwierdzono, że prawdopodobieństwo zgonu z powodu COVID-19 wśród osób nie stosujących iwermektyny było dwukrotnie wyższe niż wśród osób stosujących iwermektynę. Ponieważ grupy były porównywane pod względem ekspozycji w tym samym okresie, w sposób równoległy, zmiany w szybkości transmisji wpłynęłyby w równym stopniu na osoby stosujące iwermektynę i osoby jej nie stosujące.
Miasto Itajaí, w stanie Santa Catarina w Brazylii, rozpoczęło ogólnomiejski program profilaktyki iwermektyną w lipcu 2020 roku jako część kilku inicjatyw mających na celu zmniejszenie obciążenia COVID-19. Zastosowanie iwermektyny było oparte na istniejącej wówczas literaturze i na praktycznie całkowitym braku ryzyka. Funkcje Narodowego Systemu Zdrowia (SUS) jako pełnego wsparcia opieki zdrowotnej dla całej populacji pozwoliły miastu na ustanowienie programu populacji nieobjętej ograniczeniami. Program ten obejmował strukturę wsparcia składającą się z dużej przychodni znajdującej się w Centrum Kongresowym w Itajaí. Przychodnia ta stała się głównym miejscem pomocy dla pacjentów COVID-19, wspieranym przez wiele placówek publicznych, w których lekarze ogólni regularnie przyjmowali pacjentów.
Stosowanie iwermektyny było opcjonalne, o ile nie było przeciwwskazań, i podawane według uznania lekarza. W ramach zorganizowanego programu opartego na medycynie, obejmującego wizytę lekarską i ocenę podstawowych cech demograficznych oraz chorób współistniejących, oferowano iwermektynę jako opcjonalną profilaktykę tym osobom, które zgodziły się uczestniczyć w tym programie leczenia zapobiegawczego. Stan zdrowia był oceniany, a dane wprowadzano prospektywnie przez cały okres trwania programu, w całkowicie cyfrowym systemie dostarczonym przez Narodowy System Zdrowia (SUS). Ponieważ system ten istniał przed pandemią, znaczna część populacji była już zarejestrowana wraz z informacjami o stanie zdrowia, w tym o przebytych i aktualnych chorobach, stosowaniu leków i innych cechach. Dostosowanie SUS do gotowości na pandemię, przed rozpoczęciem tego programu ambulatoryjnego iwermektyny, pozwoliło na ustrukturyzowane, dobrze zorganizowane zbieranie danych, które monitorowało wszelkie brakujące wartości, wzmacniając wiarygodność wyników.
Występowała istotna tendencyjność konserwatywna. Główne czynniki ryzyka ciężkiego przebiegu COVID-19 i śmiertelności z powodu COVID-19, w tym starzenie się, cukrzyca i nadciśnienie tętnicze, były bardziej obecne wśród osób stosujących iwermektynę, co mogło spowodować niedoszacowanie korzyści wynikających ze stosowania iwermektyny, ponieważ wykazano jej szczególną skuteczność u osób w wieku powyżej 49 lat pod względem zmniejszenia ryzyka bezwzględnego, co odpowiada grupie najwyższego ryzyka dla COVID-19. Pozwala to zrozumieć, że profilaktyczne stosowanie iwermektyny może być szczególnie skuteczne u osób starszych. Ponadto, iwermektyna wydawała się zmniejszać przekraczające ryzyko nadciśnienia tętniczego, T2D i innych chorób.
Zgodnie z danymi z piśmiennictwa, osoby z wyższym wiekiem, cukrzycą i mężczyźni mieli mniejsze szanse na przeżycie (p < 0,05 dla wszystkich), a jedynie starzenie się pozostało niezależnym czynnikiem ryzyka po PSM (p < 0,0001). Wydaje się jednak, że profilaktyczne stosowanie iwermektyny łagodzi dodatkowe ryzyko śmierci COVID-19 z powodu T2D, nadciśnienia tętniczego i chorób sercowo-naczyniowych.
Twierdzenia, że stosowanie terapii zapobiegawczych i wczesnego leczenia spowoduje, że ludzie rozluźnią swoje zachowania ostrożnościowe, pozostając społecznie i fizycznie zdystansowani, aby umożliwić więcej infekcji związanych z COVID-19, nie zostały tutaj potwierdzone. Dane z powyższych badań pokazują, że stosowanie profilaktycznej iwermektyny znacząco obniża częstość zakażeń i że korzyści przewyższają przypuszczalne zwiększone ryzyko zmian w zachowaniach społecznych. W związku z tym możemy spekulować, że profilaktyczne stosowanie iwermektyny może odgrywać ważną rolę w zmniejszaniu obciążenia pandemią.
Nawet po dostosowaniu do pomiaru najbardziej istotnych zmiennych, które mogłyby wpłynąć na wyniki związane z COVID-19, w tym wiek, płeć, choroby współistniejące i nawyki, w celu uniknięcia przeszacowania efektów iwermektyny i upodobnienia się do randomizowanego badania klinicznego, profilaktyczna iwermektyna okazała się być ochronna dla całej populacji, z redukcją śmiertelności o 68% i p < 0,0001 po zastosowaniu PSM.
Ochrona zapewniona przez iwermektynę stosowaną profilaktycznie w przypadku COVID-19 mogła znaleźć odzwierciedlenie w zmniejszeniu wskaźników hospitalizacji i śmiertelności z powodu COVID-19 obserwowanych na poziomie populacyjnym. W porównaniu z okresem przed rozpoczęciem programu, wskaźniki hospitalizacji i śmiertelności z powodu COVID-19 zostały zmniejszone odpowiednio o 73% i 59% (p < 0,0001 dla obu). Redukcje te uzyskano po uwzględnieniu całej populacji oraz liczby przypadków COVID-19, hospitalizacji i zgonów w mieście Itajaí, niezależnie od odsetka pacjentów stosujących profilaktycznie iwermektynę. Nie zaobserwowano zmian w wariantach SARS-CoV-2, zakaźności i patogenności przed i w trakcie trwania programu.
W porównaniu do wszystkich innych głównych miast stanu Santa Catarina, różnice w śmiertelności z powodu COVID-19 przed 7 lipca 2020 roku i między 7 lipca 2020 roku a 21 grudnia 2020 roku, Itajaí znalazło się na pierwszym miejscu.35 Wyniki te wskazują, że opcjonalne przepisywanie ivermektyny przez lekarzy oraz objęcie jej refundacją w całym mieście może mieć pozytywny wpływ na system opieki zdrowotnej. Jednakże, obecne wyniki nie dostarczają wystarczającego wsparcia dla hipotezy, że iwermektyna mogłaby być alternatywą dla szczepionek COVID-19.
Ze względu na dużą liczbę uczestników, przedstawiony w niniejszym artykule ogólnomiejski program nie był w stanie nadzorować, czy osoby stosujące iwermektynę stosowały ją regularnie, chociaż skumulowana liczba tabletek iwermektyny była ściśle kontrolowana. Okazało się, że może to być potencjalnie konserwatywne uprzedzenie, ponieważ wpływ iwermektyny na profilaktykę może być niedoszacowany ze względu na przestrzeganie zalecanej częstotliwości stosowania iwermektyny.
Chociaż iwermektyna jest lekiem o wielu celach36, jej maksymalne korzyści występują, gdy jest obecna w minimalnym stężeniu w wielu miejscach, aby hamować wiele szlaków metabolicznych i zapalnych. Jednakże, mimo że dawka iwermektyny zastosowana w programie była mniejsza niż minimalna, aby osiągnąć stężenie wymagane do działania w tych wielu miejscach, redukcja zakażenia, śmiertelności i umieralności w grupie zakażonej, która stosowała iwermektynę profilaktycznie, była zaskakująco niższa. Długotrwała lub skumulowana iwermektyna mogła również odgrywać decydującą rolę w jej długotrwałej ochronie przed COVID-19.
Ograniczenia
Ponieważ było to prospektywne badanie obserwacyjne, które pozwoliło uczestnikom na samodzielny wybór między leczeniem a nieleczeniem, zamiast polegać na randomizacji, ważne czynniki zakłócające mogły być obecne w różnym stopniu, co mogłoby w inny sposób wyjaśnić obserwowane różnice. Biorąc pod uwagę, że zmierzone korzyści wystąpiły pomimo tego, że negatywne czynniki ryzyka były bardziej obecne w grupie leczonej, sugeruje to, że korzyści są prawdopodobnie dokładne i nieobiektywne. Ponadto wykazano, że badania opierające się na technikach PSM są zgodne z tymi, w których zastosowano randomizację37,38, ponownie wspierając prawdopodobieństwo, że mierzone korzyści są dokładne. Dominujący typ SARS-CoV-2 w mieście nie był znany ze względu na brak nadzoru genotypowego w okresie trwania programu. Nie wiadomo, czy profilaktyka zaproponowana w tym programie byłaby równie skuteczna w przypadku innych wariantów SARS-CoV-2. Nie było również ścisłej kontroli nad tym, czy zakażeni stosowali jakieś konkretne leki w przypadku zakażenia COVID-19, a to dopuszcza możliwość, że różnice mogą być wyjaśnione różnicami w stosowaniu iwermektyny lub innych leków jako leczenia.
Dyskusja końcowa
W opisanym powyżej ogólnomiejskim programie profilaktyki iwermektynowej zaobserwowano duży, istotny statystycznie spadek śmiertelności po rozpoczęciu programu wśród całej populacji mieszkańców miasta. Porównując osoby, które regularnie stosowały iwermektynę do osób jej nie stosujących, te drugie były dwukrotnie bardziej narażone na zgon z powodu COVID-19, podczas gdy osoby stosujące iwermektynę były o 7% mniej narażone na zakażenie SARS-CoV-2 (p = 0,003).
Chociaż opisane badanie nie jest randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniem klinicznym, dane były zbierane prospektywnie i skutkowały ogromną próbą badawczą, która umożliwiła dostosowanie do licznych czynników zakłócających, co wzmocniło wyniki niniejszego badania.
Ze względu na dobrze ustalony, długoterminowy profil bezpieczeństwa iwermektyny, z rzadkimi działaniami niepożądanymi, brak sprawdzonych opcji terapeutycznych w zapobieganiu zgonom spowodowanym przez COVID-19 oraz brak skuteczności szczepionek w dotychczasowych analizach rzeczywistej śmiertelności z wszystkich przyczyn, zalecamy rozważenie iwermektyny jako strategii profilaktycznej, w szczególności dla osób o wyższym ryzyku powikłań spowodowanych przez COVID-19 lub o wyższym ryzyku zachorowania na tę chorobę, nie jako substytutu szczepionek przeciwko COVID-19, ale jako dodatkowego narzędzia, szczególnie w okresach wysokiej transmisji.
Wnioski
W ogólnomiejskim programie iwermektynowym z profilaktycznym, opcjonalnym stosowaniem iwermektyny w przypadku COVID-19, iwermektyna wiązała się z istotnym zmniejszeniem liczby zakażeń COVID-19, hospitalizacji i zgonów z powodu COVID-19.
Załączniki
Spis treści
- Lista kontrolna systemu STROBE
- Niedopasowana analiza zakażonych pacjentó
- Czynniki determinujące śmiertelność COVID-19 przed dopasowanie
- Osoby stosujące iwermektynę w porównaniu z osobami niestosującymi iwermektyny w subpopulacjac
- Niezrównana analiza
- Analiza porównawcza (propensity score-matched
- Modyfikacja protokołu w celu obliczenia wskaźników zakażeń
Lista kontrolna systemu STROBE
W tabeli 5 opisano listę kontrolną STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) dotyczącą tego badania.
|
Tabela 5: Lista kontrolna STROBE. STROBE = Strengthening the Reporting of Observational Studies in Epidemiology (Wzmocnienie zgłaszania badań obserwacyjnych w epidemiologii). |
Niedopasowana analiza zakażonych pacjentów
W tabeli 6 porównano wskaźniki hospitalizacji i śmiertelności wśród pacjentów zakażonych COVID-19 pomiędzy stosującymi iwermektynę i niestosującymi. Spośród 7 345 osób z COVID-19, było 185 hospitalizacji (2,52% wskaźnik hospitalizacji) wśród osób nie stosujących iwermektyny. Wśród 4 311 osób stosujących iwermektynę, było 86 hospitalizacji (wskaźnik hospitalizacji 2,0%), podczas gdy wśród 3 034 osób nie stosujących iwermektyny było 99 hospitalizacji (wskaźnik hospitalizacji 3,3%), z redukcją wskaźnika hospitalizacji spowodowaną przez COVID-19 o 39% (RR, 0,61; 95%). (RR, 0,61; 95% przedział ufności, 0,46-0,81; p = 0,0007). Po skorygowaniu o zmienne, redukcja częstości hospitalizacji wyniosła 59% (RR < 0,41; 95% przedział ufności, 0,31-0,55; p < 0,0001).
Tab. 6: Zakażenie, hospitalizacja, zgon i współczynnik umieralności w grupie osób stosujących iwermektynę
i osób nie stosujących iwermektyny. IVM = iwermektyna; CI = przedział ufności. * Tylko osoby hospitalizowane w szpitalach publicznych. ** Wszystkie zgony, w tym w szpitalach publicznych i prywatnych oraz w domu.
Wśród 7 345 osób z obu grup stosujących COVID-19, było 141 zgonów (śmiertelność 1,9%). Wśród 4 311 osób stosujących iwermektynę wystąpiły 62 zgony (śmiertelność 1,4%), natomiast wśród 3 034 osób, które nie stosowały profilaktycznie iwermektyny, było 79 zgonów (śmiertelność 2,6%), przy zmniejszeniu śmiertelności o 45% (RR, 0,55; 95% przedział ufności, 0,40-0,77; p = 0,0004). Po skorygowaniu o zmienne resztkowe, redukcja śmiertelności COVID-19 wyniosła 57% (RR, 0,43; 95% przedział ufności, 0,32-0,59; p <0,0001).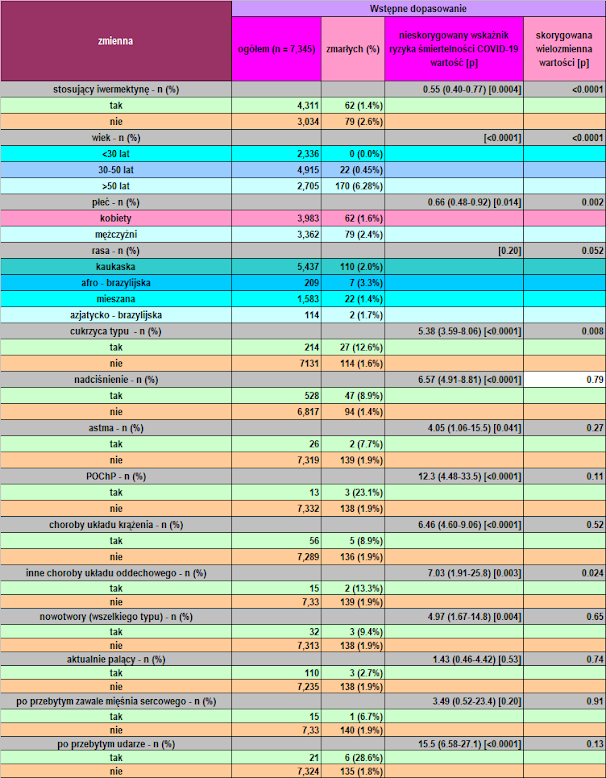
| Tab. 7: Współczynnik umieralności przed dopasowaniem COVID-19 według każdej cechy w całej populacji ogólnej, osób stosujących iwermektynę i osób niestosujących tej substancji. |
Subpopulacje osób stosujących iwermektynę i osób niestosujących tej metody
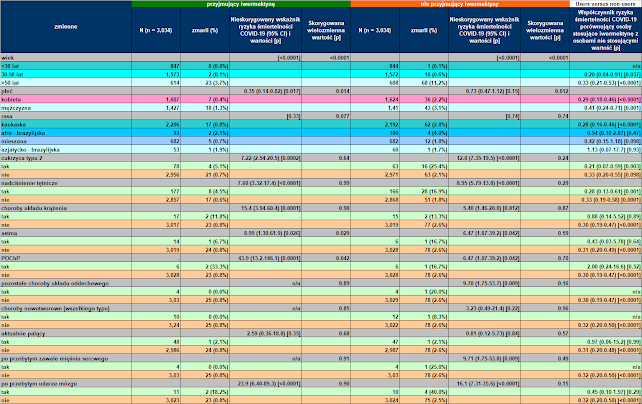
Tabele 8, 9 przedstawiają różnice w śmiertelności w różnych subpopulacjach osób stosujących iwermektynę i osób nie stosujących iwermektyny oraz porównanie wskaźników śmiertelności w każdej subpopulacji pomiędzy osobami stosującymi iwermektynę i osobami i nieużywającymi, odpowiednio przed i po dopasowaniu.
| Tab. 8: Wskaźnik śmiertelności przed dopasowaniem COVID-19 według każdej cechy u osób stosujących iwermektynę i osób niestosujących iwermektyny oraz współczynnik umieralności pomiędzy osobami stosującymi iwermektynę a osobami niestosującymi jej w każdej grupie. CI = przedział ufności; n/a = nie dotyczy. |
PSM: dopasowanie wyników za pomocą metody propensity score, CI: przedział ufności.
Analiza bez dopasowania
Przed dopasowaniem (Tabela 8), nieskorygowane wartości wykazały, że czynnikami ryzyka zarówno dla osób stosujących iwermektynę, jak i niestosujących były: starzenie się (p < 0,0001 dla obu), cukrzyca typu 2 (p < 0,0001 dla obu), nadciśnienie (p < 0,0001 dla obu), choroby układu krążenia (p = 0. 003 i p = 0,012, odpowiednio), POChP (p < 0,0001 i p = 0,042, odpowiednio), inne choroby płuc (p = 0,041 i p = 0,009, odpowiednio) i udar mózgu w wywiadzie (p = 0,0001 i p <0,0001, odpowiednio). Płeć męska i nowotwory były czynnikami ryzyka dla osób stosujących iwermektynę (odpowiednio p = 0,044 i p = 0,22). Przebyty zawał serca był czynnikiem ryzyka dla osób nie stosujących iwermektyny (p = 0,009).
Po skorygowaniu zmiennych, pozostałe niezależne czynniki ryzyka obejmowały wiek, zarówno dla osób stosujących iwermektynę (p< 0,0001), jak i niestosujących (p < 0,0001), płeć męską dla niestosujących (p = 0,012) oraz cukrzycę typu 2 dla niestosujących iwermektyny (p = 0,024).
Śmiertelność wśród osób stosujących iwermektynę była statystycznie mniejsza niż wśród osób niestosujących jej w następujących grupach: w wieku od 31 do 49 lat (RR, 0,15; 95% przedział ufności, 0,03-0,68; p = 0,014), powyżej 50 lat (RR, 0,41; 95% przedział ufności, 0,30-0,57; p < 0,0001), płci męskiej (RR, 0,60; 95% CI, 0. 39-0,94; p = 0,024), płeć żeńska (RR, 0,50; 95% CI, 0,30-0,82; p = 0,006), rasa kaukaska (RR, 0,52; 95% przedział ufności, 0,36-0,76; p = 0,0007), osoby z cukrzycą typu 2 (RR, 0,29; 95% przedział ufności, 0,14-0,58; p = 0,0006), z nadciśnieniem tętniczym (RR, 0,33; 95% przedział ufności, 0,19-0,57; p = 0,0001) oraz osoby bez nadciśnienia tętniczego, cukrzycy typu 2, POChP, astmy, innych chorób płuc, chorób nowotworowych różnego typu, przebytego zawału serca, przebytego udaru mózgu i niepalących (RR, 0,54-0,61; 95% przedział ufności, 0,19-0,91; p = 0,0003 do 0,017).
Względne zmniejszenie ryzyka śmiertelności związane ze stosowaniem iwermektyny było bardziej znaczące u osób z głównymi powszechnymi chorobami współistniejącymi, w tym cukrzycą typu 2 (zmniejszenie o 71% wśród osób z cukrzycą typu 2 w porównaniu z 42% wśród osób bez cukrzycy typu 2 ), nadciśnieniem tętniczym (zmniejszenie wskaźnika zgonów COVID-19 o 67% wśród osób z nadciśnieniem tętniczym w porównaniu z 39% wśród osób bez nadciśnienia tętniczego), astma (zmniejszenie częstości zgonów COVID-19 o 70% wśród osób z astmą w porównaniu z 45% wśród osób bez astmy) oraz przebyty zawał serca (zmniejszenie częstości zgonów COVID-19 o 86% wśród osób z przebytym zawałem serca w porównaniu z 44% wśród osób bez przebytego zawału serca). Redukcja ryzyka zgonu była większa u kobiet (50%) niż u mężczyzn (40%), u osób rasy kaukaskiej (48%) niż u osób rasy mieszanej (37%) i afro-brazylijczyków (31%) oraz w wieku od 30 do 50 lat (85%) niż powyżej 50 lat (59%). Jednak bezwzględne zmniejszenie ryzyka było większe u osób w wieku powyżej 50 lat (6,6 punktu procentowego [p.p.]) niż u osób w wieku od 30 do 50 lat (0,5 p.p.) i poniżej 30 lat (0,1 p.p.).
Analiza dopasowania metodą proporcjonalności (propensity score-matched)
W Tabeli 9 opisano współczynniki umieralności dopasowane metodą proporcjonalności w subpopulacjach osób stosujących iwermektynę i osób niestosujących iwermektyny, a następnie porównano osoby stosujące iwermektynę i osoby niestosujące dla każdej cechy. Rycina 3 ilustruje wskaźniki śmiertelności COVID-19 w subpopulacjach po dopasowaniu. Wskaźniki śmiertelności po dopasowaniu współczynniki ryzyka i wartości [p] wśród osób nie stosujących iwermektyny pozostały takie same jak przed dopasowaniem. Wśród osób stosujących iwermektynę wartości te były następujące: wiek (p < 0,0001), płeć męska (p = 0,017), T2D (p = 0,0002), nadciśnienie tętnicze (p <0,0001), CVD (p = 0,0001), astma (p = 0,026), POChP (p = 0,0001) i udar mózgu w wywiadzie (p < 0,0001). Nie odnotowano zgonów u osób stosujących iwermektynę z innymi chorobami płuc, nowotworami i przebytym zawałem serca.
Po PSM stosunek umieralności osób stosujących iwermektynę do osób niestosujących iwermektyny wykazał statystyczne zmniejszenie umieralności przy stosowaniu iwermektyny u osób powyżej 30 roku życia (30-50 lat; RR, 0. 20; 95% przedział ufności, 0,04-0,91; p = 0,037; >50 lat; RR, 0,33; 95% przedział ufności, 0,21-0,53; p < 0,0001), u obu płci (płeć męska; RR, 0,41; 95% przedział ufności, 0,24-0,71; p = 0,001; płeć żeńska; RR, 0,29; 95% przedział ufności, 0,18-0. 46; p < 0,0001), osoby rasy kaukaskiej (RR, 0,28; 95% przedział ufności, 0,16-0,46; p < 0,0001), osoby z T2D (RR, 0,21; 95% przedział ufności, 0,07-0,59; p = 0,003), z nadciśnieniem tętniczym (RR, 0,28; 95% przedział ufności, 0,13-0,61; p = 0. 001), oraz osób bez nadciśnienia tętniczego, cukrycy typu 2, POChP, astmy, innych chorób płuc, nowotworów różnego typu, przebytego zawału serca, przebytego udaru mózgu i niepalących (RR, 0,30-0,32; 95% przedział ufności, 0,19-0,58; p < 0,0001 dla wszystkich, z wyjątkiem braku cukrzycy, p = 0,098).
Po dopasowaniu względna redukcja ryzyka śmiertelności w przypadku stosowania iwermektyny była nieco większa u osób z cukrzycą typu 2 (redukcja o 79% i 67% odpowiednio wśród osób z cukrzycą typu 2 i bez cukrzycy typu 2) i nadciśnieniem tętniczym (redukcja śmiertelności COVID-19 o 72% i 67% odpowiednio wśród osób z nadciśnieniem i bez nadciśnienia), ale nie z innymi chorobami współistniejącymi. Bezwzględna redukcja ryzyka była większa wśród osób w wieku powyżej 50 lat, z 75 osób uratowanych na każde 1000 osób zakażonych COVID-19 (7,5 p.p.), niż u osób w wieku od 30 do 50 lat (0,5 p.p.; pięć osób uratowanych na każde 1000 przypadków COVID-19) i poniżej 30 lat (0,1 p.p.; jeden podmiot uratowany na każde 1000 przypadków COVID-19).
Modyfikacja protokołu w celu obliczenia wskaźników zakażeń
Wcześniej braliśmy pod uwagę całą populację miasta Itajaí jako źródło do obliczania liczby osób niestosujących iwermektyny, co fałszywie zwiększyło liczbę osób niestosujących i, w konsekwencji, fałszywie zmniejszyło wskaźnik infekcji wśród osób niestosujących iwermektyny. Wykluczyliśmy również osoby poniżej 18 roku życia i uczestników z innych miast, ponieważ ich wyniki nie byłyby uwzględnione w statystykach miasta Itajaí. Rycina 4 podsumowuje modyfikacje.
Informacje dodatkowe
Ujawnienie informacji
Podmioty ludzkie: Zgoda została uzyskana lub uchylona przez wszystkich uczestników tego badania. Krajowa Rada Etyki Badań Naukowych (CONEP) wydała zgodę 4.821.082. Obecna retrospektywna analiza prospektywnie zebranych danych została zatwierdzona przez Krajową Radę Etyki Badań Naukowych (CONEP) pod numerem 4.821.082 z numerem projektu CAAE: 47124221.2.0000.5485. Mimo, iż projekt badania, zatwierdzenie IRB i analiza danych miały miejsce po zakończeniu dobrowolnego programu profilaktyki, wszystkie dane były gromadzone prospektywnie w czasie rzeczywistym, z obowiązkowym raportowaniem do rejestru wszystkich zdarzeń, które wystąpiły podczas ogólnomiejskiego rządowego programu profilaktyki COVID-19 z iwermektyną, od lipca 2020 do grudnia 2020, opracowanego w mieście Itajaí, w stanie Santa Catarina, Brazylia. Zwierzęta: Wszyscy autorzy potwierdzili, że to badanie nie obejmowało obiektów lub tkanek zwierzęcych. Konflikty interesów: Zgodnie z jednolitym formularzem ICMJE dotyczącym ujawniania informacji, wszyscy autorzy deklarują następujące kwestie:
Informacje o płatnościach/usługach: Wszyscy autorzy oświadczyli, że nie otrzymali wsparcia finansowego od żadnej organizacji w związku z przedstawioną pracą.
Powiązania finansowe: Wszyscy autorzy oświadczyli, że nie mają obecnie ani w ciągu ostatnich trzech lat żadnych powiązań finansowych z organizacjami, które mogłyby mieć związek z przedstawioną pracą.
Inne powiązania: Wszyscy autorzy oświadczyli, że nie mają żadnych innych związków ani działań, które mogłyby mieć wpływ na przedstawioną pracę.
Podziękowania
Dziękujemy Pani doktor Volnei José Morastoni, burmistrzowi miasta Itajaí, stan Santa Catarina, Brazylia, za opracowanie i umożliwienie realizacji ogólnomiejskiego programu stosowania iwermektyny w profilaktyce COVID-19. Dziękujemy również wszystkim pracownikom, którzy pracowali przy ogólnomiejskim programie profilaktyki COVID-19 z zastosowaniem iwermektyny w Itajaí, stan Santa Catarina, Brazylia, a także tym, którzy bezpośrednio lub pośrednio oferowali wsparcie pro bono dla uczestników programu, kompilacji danych lub byli zaangażowani w jakikolwiek inny krok, który doprowadził do niniejszej analizy.
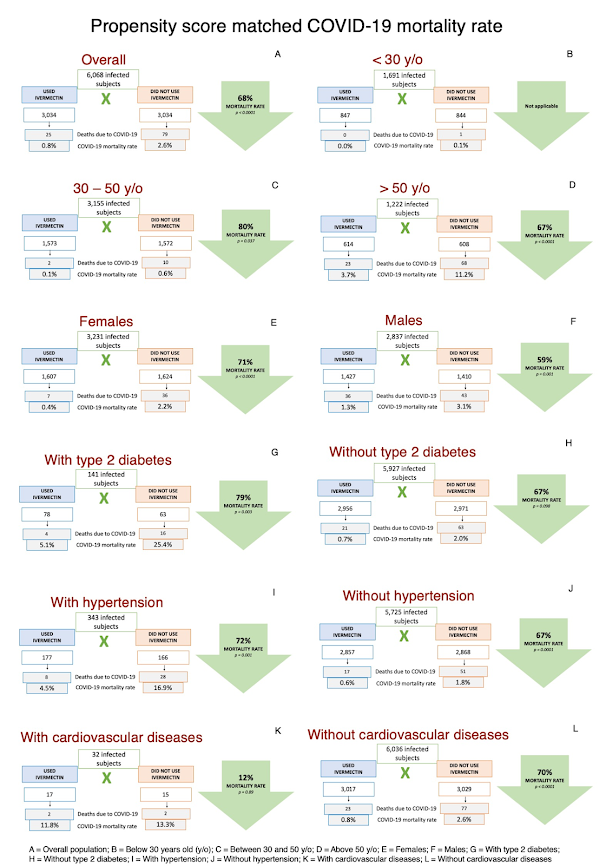
| Ryc. 3: Współczynniki śmiertelności COVID-19 w subpopulacjach dopasowanych metodą proporcjonalności w subpopulacjach. |
| Ryc. 4: Modyfikacje w zgłaszanym zmniejszeniu liczby zakażeń przy profilaktyki iwermektyną dla COVID-19. |
Opracował: Marek Skowroński
Przypisy:
- Chen IS, Kubo Y: Ivermectin and its target molecules: shared and unique modulation mechanisms of ion channels and receptors by ivermectin. J Physiol. 2018, 596:1833-45. 10.1113/JP275236
- Kaur H, Shekhar N, Sharma S, Sarma P, Prakash A, Medhi B: Ivermectin as a potential drug for treatment of COVID-19: an in-sync review with clinical and computational attributes. Pharmacol Rep. 2021, 73:736-49. 10.1007/s43440-020-00195-y
- Martin RJ, Robertson AP, Choudhary S: Ivermectin: an anthelmintic, an insecticide, and much more. Trends Parasitol. 2021, 37:48-64. 10.1016/j.pt.2020.10.005
- Mastrangelo E, Pezzullo M, De Burghgraeve T, et al.: Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: new prospects for an old drug. J Antimicrob Chemother. 2012, 67:1884-94. 10.1093/jac/dks147
- Wagstaff KM, Sivakumaran H, Heaton SM, Harrich D, Jans DA: Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus. Biochem J. 2012, 443:851-6. 10.1042/BJ20120150
- Crump A: Ivermectin: enigmatic multifaceted 'wonder' drug continues to surprise and exceed expectations. J Antibiot (Tokyo). 2017, 70:495-505. 10.1038/ja.2017.11
- Heidary F, Gharebaghi R: Ivermectin: a systematic review from antiviral effects to COVID-19 complementary regimen. J Antibiot (Tokyo). 2020, 73:593-602. 10.1038/s41429-020-0336-z
- Li N, Zhao L, Zhan X: Quantitative proteomics reveals a broad-spectrum antiviral property of ivermectin, benefiting for COVID-19 treatment. J Cell Physiol. 2021, 236:2959-75. 10.1002/jcp.30055
- Jin L, Feng X, Rong H, et al.: The antiparasitic drug ivermectin is a novel FXR ligand that regulates metabolism. Nat Commun. 2013, 4:1937. 10.1038/ncomms2924
- Yang JS, Qi W, Farias-Pereira R, Choi S, Clark JM, Kim D, Park Y: Permethrin and ivermectin modulate lipid metabolism in steatosis-induced HepG2 hepatocyte. Food Chem Toxicol. 2019, 125:595-604. 10.1016/j.fct.2019.02.005
- Cairns DM, Giordano JE, Conte S, Levin M, Kaplan DL: Ivermectin promotes peripheral nerve regeneration during wound healing. ACS Omega. 2018, 3:12392-402. 10.1021/acsomega.8b01451
- Zheng YY, Ma YT, Zhang JY, Xie X: COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020, 17:259-60. 10.1038/s41569-020-0360-5
- Nagai H, Satomi T, Abiru A, et al.: Antihypertrophic effects of small molecules that maintain mitochondrial ATP levels under hypoxia. EBioMedicine. 2017, 24:147-58. 10.1016/j.ebiom.2017.09.022
- Park A, Iwasaki A: Type I and type III interferons - induction, signaling, evasion, and application to combat COVID-19. Cell Host Microbe. 2020, 27:870-8. 10.1016/j.chom.2020.05.008
- Zhang X, Song Y, Ci X, et al.: Ivermectin inhibits LPS-induced production of inflammatory cytokines and improves LPS-induced survival in mice. Inflamm Res. 2008, 57:524-9. 10.1007/s00011-008-8007-8
- Okeahialam BN: Serine protease inhibitors could be of benefit in the treatment of COVID-19 disease. Ther Adv Infect Dis. 2021, 8:10.1177/20499361211032048
- Matsuyama T, Kubli SP, Yoshinaga SK, Pfeffer K, Mak TW: An aberrant STAT pathway is central to COVID-19. Cell Death Differ. 2020, 27:3209-25. 10.1038/s41418-020-00633-7
- Wang K, Gao W, Dou Q, Chen H, Li Q, Nice EC, Huang C: Ivermectin induces PAK1-mediated cytostatic autophagy in breast cancer. Autophagy. 2016, 12:2498-9. 10.1080/15548627.2016.1231494
- Dou Q, Chen HN, Wang K, et al.: Ivermectin induces cytostatic autophagy by blocking the PAK1/Akt axis in breast cancer. Cancer Res. 2016, 76:4457-69. 10.1158/0008-5472.CAN-15-2887
- Layhadi JA, Turner J, Crossman D, Fountain SJ: ATP evokes Ca2+ responses and CXCL5 secretion via P2X4 receptor activation in human monocyte-derived macrophages. J Immunol. 2018, 200:1159-68. 10.4049/jimmunol.1700965
- Juarez M, Schcolnik-Cabrera A, Dueñas-Gonzalez A: The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug. Am J Cancer Res. 2018, 8:317-31.
- Andersson U, Ottestad W, Tracey KJ: Extracellular HMGB1: a therapeutic target in severe pulmonary inflammation including COVID-19?. Mol Med. 2020, 26:42. 10.1186/s10020-020-00172-4
- Yan S, Ci X, Chen N, et al.: Anti-inflammatory effects of ivermectin in mouse model of allergic asthma. Inflamm Res. 2011, 60:589-96. 10.1007/s00011-011-0307-8
- Reis TA, Oliveira-da-Silva JA, Tavares GS, et al.: Ivermectin presents effective and selective antileishmanial activity in vitro and in vivo against Leishmania infantum and is therapeutic against visceral leishmaniasis. Exp Parasitol. 2021, 221:108059. 10.1016/j.exppara.2020.108059
- Scheim D: Ivermectin for COVID-19 treatment: clinical response at quasi-threshold doses via hypothesized alleviation of CD147-mediated vascular occlusion. [PREPRINT]. SSRN J. 2020, 10.2139/ssrn.3636557
- Ci X, Li H, Yu Q, et al.: Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen-activated protein kinase activation pathway. Fundam Clin Pharmacol. 2009, 23:449-55. 10.1111/j.1472-8206.2009.00684.x
- Zaidi AK, Dehgani-Mobaraki P: The mechanisms of action of Ivermectin against SARS-CoV-2: an evidence-based clinical review article. [PREPRINT]. J Antibiot (Tokyo). 2021, 10.1038/s41429-021-00430-5
- Kalfas S, Visvanathan K, Chan K, Drago J: The therapeutic potential of ivermectin for COVID- 19: a systematic review of mechanisms and evidence. [PREPRINT]. medRxiv. 2020, 10.1101/2020.11.30.20236570
- Behera P, Patro BK, Singh AK, et al.: Role of ivermectin in the prevention of SARS-CoV-2 infection among healthcare workers in India: a matched case-control study. PLoS One. 2021, 16:e0247163. 10.1371/journal.pone.0247163
- Hellwig MD, Maia A: A COVID-19 prophylaxis? Lower incidence associated with prophylactic administration of ivermectin. Int J Antimicrob Agents. 2021, 57:106248. 10.1016/j.ijantimicag.2020.106248
- World Medical Association. Declaration of Helsinki. (2020). Accessed: December 24, 2021: https://www.wma.net/what-we-do/medical-ethics/declaration-of-helsinki/doh-oct2000/.
- Conselho Federal de Medicina (CFM). Código de Ética Médica. (2010). Accessed: December 24, 2021: https://portal.cfm.org.br/images/stories/biblioteca/codigo%20de%20etica%20medica.pdf.
- Nguyen TL, Collins GS, Spence J, Daurès JP, Devereaux PJ, Landais P, Le Manach Y: Double-adjustment in propensity score matching analysis: choosing a threshold for considering residual imbalance. BMC Med Res Methodol. 2017, 17:78. 10.1186/s12874-017-0338-0
- Zhang Z, Kim HJ, Lonjon G, Zhu Y: Balance diagnostics after propensity score matching. Ann Transl Med. 2019, 7:16. 10.21037/atm.2018.12.10
- Boletim epidemiológico do estado de Santa Catarina, Brasil. (2020). Accessed: December 24, 2021: http://www.dive.sc.gov.br.
- Choudhury A, Das NC, Patra R, Bhattacharya M, Ghosh P, Patra BC, Mukherjee S: Exploring the binding efficacy of ivermectin against the key proteins of SARS-CoV-2 pathogenesis: an in silico approach. Future Virol. 2021, 16:277-91. 10.2217/fvl-2020-0342
- Austin PC: An introduction to propensity score methods for reducing the effects of confounding in observational studies. Multivariate Behav Res. 2011, 46:399-424. 10.1080/00273171.2011.568786
- Propensity score matching in the absence of randomized controlled trials: a case study on the effects of breastfeeding on childhood obesity. (2020). Accessed: December 24, 2021: https://methods.sagepub.com/case/propensity-score-matching-trials-effects-breastfeeding-childhood-obesity.