"Szczepionki" przeciw COVID-19
Badanie wykazujące, że nie ma wzrostu częstości występowania zapalenia mięśnia sercowego i osierdzia u pacjentów NIESZCZEPIONYCH zakażonych COVID-19 w porównaniu z niezakażonymi, dobranymi kontrolami:
Niestety, "szczepionki" przeciw COVID-19 zwiększają ryzyko wystąpienia zapalenia mięśnia sercowego i to w młodych grupach wiekowych, w tym u dzieci, u których ryzyko ciężkiego przechorowania jest niewielkie, pisaliśmy o tym wcześniej:

Opublikowane 14 kwietnia 2022 roku w Journal of Clinical Medicine duże badanie populacyjne
The Incidence of Myocarditis and Pericarditis in Post COVID-19 Unvaccinated Patients-A Large Population-Based Study
sugeruje wyraźnie, że nie ma wzrostu częstości występowania zapalenia mięśnia sercowego i osierdzia u pacjentów zakażonych COVID-19 w porównaniu z niezakażonymi, dobranymi kontrolami.
Streszczenie:
Zapalenie mięśnia sercowego i osierdzia są potencjalnymi następstwami zakażenia wirusem COVID-19, wynikającymi z adaptacyjnej odpowiedzi immunologicznej. Naszym celem było zbadanie częstości występowania zapalenia mięśnia sercowego i osierdzia po zakażeniu wirusem COVID-19. Retrospektywne badanie kohortowe 196 992 dorosłych po zakażeniu wirusem COVID-19 u członków Clalit Health Services w Izraelu w okresie od marca 2020 r. do stycznia 2021 r. Diagnozy zapalenia mięśnia sercowego i osierdzia w warunkach szpitalnych były pobierane od 10. dnia po uzyskaniu dodatniego wyniku badania PCR. Kontrolę cenzurowano 28 lutego 2021 r., przy minimalnym okresie obserwacji wynoszącym 18 dni. Kohorta kontrolna składająca się z 590 976 dorosłych z co najmniej jednym ujemnym wynikiem badania PCR i bez dodatniego wyniku badania PCR była dobrana pod względem wieku i płci. Ponieważ izraelski program szczepień rozpoczęto 20 grudnia 2020 roku, dopasowanie czasowe kohorty kontrolnej obliczono wstecz od 15 grudnia 2020 roku. U dziewięciu pacjentów po szczepieniu COVID-19 rozwinęło się zapalenie mięśnia sercowego (0,0046%), a u jedenastu pacjentów rozpoznano zapalenie osierdzia (0,0056%). W kohorcie kontrolnej u 27 pacjentów wystąpiło zapalenie mięśnia sercowego (0,0046%), a u 52 zapalenie osierdzia (0,0088%). Wiek (skorygowany współczynnik ryzyka [aHR] 0,96, 95% przedział ufności [CI]; 0,93 do 1,00) i płeć męska (aHR 4,42; 95% CI, 1,64 do 11,96) były związane z zapaleniem mięśnia sercowego. Płeć męska (aHR 1,93; 95% CI 1,09 do 3,41) i choroba naczyń obwodowych (aHR 4,20; 95% CI 1,50 do 11,72) były związane z zapaleniem osierdzia. Zakażenie post COVID-19 nie było związane ani z zapaleniem mięśnia sercowego (aHR 1,08; 95% CI 0,45 do 2,56) ani z zapaleniem osierdzia (aHR 0,53; 95% CI 0,25 do 1,13). Nie zaobserwowaliśmy zwiększonej częstości występowania ani zapalenia osierdzia, ani zapalenia mięśnia sercowego u dorosłych pacjentów powracających do zdrowia po zakażeniu COVID-19.
1. Wstęp
Choroba koronawirusowa 2019 (COVID-19), wywoływana przez koronawirus 2 (SARS-CoV-2), jest główną przyczyną zachorowalności i śmiertelności na całym świecie [1]. (wg autorów opracowania przyp.red.) Oprócz objawów klinicznych występujących w ostrej fazie choroby COVID-19, istnieje coraz więcej danych dotyczących podostrych i długoterminowych skutków COVID-19, znanych również jako "podostry zespół COVID-19" lub "long COVID", określanych jako utrzymujące się objawy kilka tygodni po rozpoczęciu zakażenia COVID-19 [2]. "Long-COVID" lub "post-acute COVID-19 syndrome" charakteryzuje się występowaniem wielonarządowych następstw lub utrzymywaniem się objawów po ustąpieniu ostrej fazy COVID-19, zwykle po 3 do 4 tygodniach od wystąpienia objawów lub pierwszego dodatniego wyniku testu PCR [3].
Patogeneza "long-COVID" może wynikać z kilku mechanizmów, w tym bezpośredniej toksyczności wirusa, nadkrzepliwości, uszkodzenia mikronaczyń i niedostosowania enzymu konwertującego angiotensynę [4]. Chociaż podstawowe mechanizmy patofizjologiczne prowadzące do powstania COVID-19 nie zostały jeszcze w pełni poznane, uważa się, że odpowiedź immunologiczna [5,6] i dysregulacja immunologiczna [4] odgrywają główną rolę w patogenezie tego zespołu. Nie ma zgodności co do tego, który punkt czasowy odpowiada przejściu od ostrej infekcji COVID-10 do fazy zdrowienia. Ponieważ rozważaliśmy pośrednie zapalenie o podłożu immunologicznym jako potencjalny mechanizm wyjaśniający opóźnione zapalenie osierdzia i mięśnia sercowego, uznaliśmy, że 10 dni po zakażeniu jest odpowiednim punktem czasowym, ponieważ jest to ważne w odniesieniu do zapalenia osierdzia po zawale serca (zespół Dresslera) lub operacji kardiochirurgicznej (zespół poperikardiotomii).
Wykazano, że przyczyny zakaźne są ważnym czynnikiem inicjującym w patofizjologii chorób autoimmunologicznych [7]. Infekcje wirusowe były również związane z występowaniem chorób autoimmunologicznych, takich jak toczeń układowy, reumatoidalne zapalenie stawów i cukrzyca [8].
W zakażeniach wirusowych w patogenezie następczego zapalenia mięśnia sercowego bierze udział zarówno bezpośredni kontakt, jak i uszkodzenie wywołane replikacją oraz mechanizmy autoimmunologiczne. Niewłaściwa regulacja limfocytów T wynikająca z obecności zmienionych autoprotein związanych z patogenem lub z mimikry molekularnej między wirusem a gospodarzem lub nadmierna aktywacja limfocytów B może prowadzić do niewłaściwego uszkodzenia tkanek gospodarza [9]. Ta opóźniona, niewłaściwa odpowiedź może wywołać autoimmunologiczne zapalenie mięśnia sercowego i osierdzia [10]. W związku z tym w podgrupie pacjentów z idiopatyczną kardiomiopatią rozstrzeniową wcześniejsze zapalenie mięśnia sercowego jest w niektórych przypadkach uważane za przyczynę, a przykładem przemawiającym za powiązaniem etiopatogenezy jest występowanie przeciwciał przeciwko adrenoreceptorowi beta 1 [11].
Kilka zjawisk autoimmunologicznych powiązano z przebytym zakażeniem COVID-19, w tym małopłytkowość indukowaną heparyną (HITT), zespoły podobne do zespołu Kawasaki (MIS-C i MIS-A), zespół Guillaina-Barrego, zapalenie naczyń i zapalenie tarczycy [8]. Można zatem postulować, że ryzyko wystąpienia autoimmunologicznego zapalenia mięśnia sercowego i osierdzia jest zwiększone u pacjentów, którzy powrócili do zdrowia po leczeniu COVID-19.
Ostatnio doniesiono, że częstość występowania zapalenia mięśnia sercowego i osierdzia jest zwiększona u pacjentów z COVID-19 w okresie ostrej choroby [12]. Jednak nie wiadomo jeszcze, czy zapalenie mięśnia sercowego i osierdzia po okresie zdrowienia jest częścią długiego zespołu COVID-19. W niniejszej pracy badaliśmy częstość występowania zapalenia mięśnia sercowego i osierdzia w dużej kohorcie pacjentów z COVID-19 po wyzdrowieniu z ostrej infekcji.
2. Metody
2.1. Teren badań
Dane obserwacyjne uzyskaliśmy z Clalit Health Services (CHS). CHS jest największą z czterech organizacji opieki zdrowotnej, które oferują obowiązkowe ubezpieczenie zdrowotne w Izraelu. CHS ubezpiecza ponad 50% populacji Izraela (>4,4 miliona osób), a populacja ubezpieczonych w CHS jest w przybliżeniu reprezentatywna dla całej populacji izraelskiej [12,13]. CHS zapewnia opiekę ambulatoryjną, a opieka stacjonarna jest rozdzielona między CHS i inne szpitale. Dane badawcze można pobrać z centralnej hurtowni danych za pomocą platformy CHS Secure Data Sharing Platform powered by MDClone (https://www.mdclone.com, dostęp: 5 września 2021 r.).
Badanie to zostało zatwierdzone przez instytucjonalną komisję rewizyjną i było zwolnione z wymogu uzyskania świadomej zgody.
2.2. Projekt badania i populacja pacjentów
Zebraliśmy dane wszystkich dorosłych pacjentów (w wieku ≥ 18 lat), u których udokumentowano dodatni wynik testu PCR na obecność COVID-19 (n = 213 624) w okresie od 7 marca 2020 r. do 31 stycznia 2021 r. (ryc. 1A). Zapisy obejmowały dane demograficzne i czynniki ryzyka sercowo-naczyniowego: status palenia tytoniu, otyłość, cukrzycę, hiperlipidemię, CKD (przewlekłą chorobę nerek), PVD (chorobę naczyń obwodowych, ACS (ostry zespół wieńcowy), nadciśnienie tętnicze, CVA (wypadek naczyniowo-mózgowy) i niewydolność serca (lista kodów Międzynarodowej Klasyfikacji Chorób (ICD-10) dla wszystkich rozpoznań, patrz Tabela S1). Kody diagnostyczne dla zapalenia mięśnia sercowego (I40, I40.9, I51.4) i zapalenia osierdzia (I30, I30.0, I30.9) były pobierane między 10 dniem po zakażeniu COVID-19 i najwcześniej między 6 miesiącem od zakażenia lub 28 lutego 2021 roku. Miało to na celu zapewnienie minimalnego okresu obserwacji wynoszącego 18 dni i maksymalnego okresu obserwacji wynoszącego sześć miesięcy. Ponieważ dane zostały pobrane w październiku 2021 roku, uwzględniliśmy ponad 6-miesięczne opóźnienie w transferze danych między szpitalami nienależącymi do CHS a hurtownią danych CHS. Ramy czasowe post-COVID zostały zdefiniowane od co najmniej dziesięciu dni od daty dodatniego wyniku testu PCR, pod warunkiem braku objawów związanych z zakażeniem COVID-19, zgodnie z definicjami izraelskiego Ministerstwa Zdrowia. Pacjenci z pierwszym szczepieniem otrzymanym przed zakażeniem COVID-19 zostali wykluczeni (n = 16 632), co dało ostateczną kohortę COVID-19 (n = 196 992).
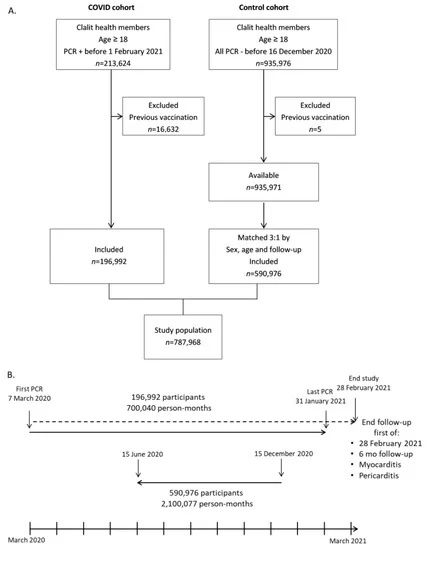
Rycina 1. Profil, plan i harmonogram badania. Clalit = Clalit Health Services. Szczepienie = szczepionka COVID-19. PCR -/+ = negatywny/pozytywny wynik PCR COVID-19. (A). Schemat blokowy doboru pacjentów w kohorcie COVID i kohorcie kontrolnej. (B). Oś czasu badania od pierwszego PCR w dniu 7 marca 2020 r. do końca badania (część dolna). Kohorta COVID jest przedstawiona w górnej części, a okres dopasowania kohorty kontrolnej jest przedstawiony w środku.
Grupę kontrolną utworzono z kohorty dorosłych pacjentów z co najmniej jednym ujemnym wynikiem badania COVID-19 PCR w okresie od 7 marca 2020 r. do 15 grudnia 2020 r. i bez wcześniejszego dodatniego wyniku badania COVID-19 PCR przed odzyskaniem danych w sierpniu 2021 r. (n = 935 976). Jako datę końcową wybrano 15 grudnia 2020 roku, ponieważ masowa izraelska kampania szczepień została rozpoczęta 20 grudnia 2020 roku. Nadal pięciu pacjentów zostało wykluczonych z powodu wcześniejszego szczepienia COVID-19. Z tej puli pacjentów (n = 935 971) utworzono kohortę kontrolną poprzez dopasowanie wieku (±2 lata) i płci w stosunku 3:1 (n = 590 976). Okres obserwacji każdego z trzech pacjentów kontrolnych był dokładnie taki sam, jak okres obserwacji dopasowanego pacjenta z grupy COVID-19. Okres obserwacji był liczony wstecz od 15 grudnia 2020 roku (ryc. 1B), aby uniknąć potencjalnego wpływu szczepienia COVID-19 na zapalenie mięśnia sercowego i osierdzia. Mimo że okres obserwacji pacjentów ze szczepionką COVID-19 trwał od marca 2020 roku do stycznia 2021 roku, prawie wszystkie przypadki COVID-19 wystąpiły między lipcem 2020 roku a styczniem 2021 roku (Rycina S1).
2.3. Analiza statystyczna
Porównaliśmy charakterystyki wyjściowe kohort za pomocą testu chi kwadrat. Użyliśmy krzywych skumulowanej częstości występowania Kaplana-Meiera, aby ocenić wpływ infekcji po zakażeniu COVID-19 na zapalenie mięśnia sercowego i osierdzia do maksymalnego okresu obserwacji wynoszącego sześć miesięcy. Zastosowano jedno- i wielowariantowe modele regresji proporcjonalnych zagrożeń Coxa. W modelach skorygowanych uwzględniono wiek, płeć, BMI, cukrzycę, hiperlipidemię, otyłość, przewlekłe uszkodzenie nerek, palenie tytoniu, chorobę naczyń obwodowych, ostry zespół wieńcowy i nadciśnienie tętnicze. Zarówno surowy iloraz zagrożeń (HR), jak i skorygowany HR (aHR) przedstawiono wraz z 95% przedziałami ufności. Wartość p mniejszą niż 0,05 uznawano za istotną statystycznie. Analizy statystyczne przeprowadzono przy użyciu programu R w wersji 4.0.2, pakietów: survival, Survminer, ggplot2 oraz programu SPSS w wersji 26 (IBM).
3. Wyniki
Do badania włączono łącznie 787 968 dorosłych członków Clalit Health Services (wiek ≥ 18 lat) (ryc. 1), w tym kohortę COVID-19 (n = 196 992) oraz kohortę kontrolną dopasowaną pod względem płci i wieku w stosunku 3:1 (n = 590 976). Całkowita długość obserwacji wynosiła 700 040 osobo-miesięcy w kohorcie COVID-19 i 2 100 077 osobo-miesięcy w kohorcie kontrolnej, z medianą obserwacji wynoszącą 4,1 miesiąca [IQR 1,3-5,6 miesiąca]. Średni wiek w obu grupach wynosił 42,4 (17,7) roku, a 45,7% stanowili mężczyźni (tab. 1). W kohorcie COVID-19 stwierdzono nieznacznie wyższy wskaźnik BMI (średnia (SD) 27,1 (7,1) vs. 26,1 (6,7) kg/m2) oraz częstsze występowanie otyłości (29,9% vs. 24,6%), cukrzycy (13% vs. 10,5%), nadciśnienia tętniczego (18,5% vs. 17%), incydentów naczyniowo-mózgowych (4% vs. 3,7%) i niewydolności serca (2,6% vs. 2,2%). W kohorcie COVID-19 odnotowano mniejszą częstość występowania palenia tytoniu obecnie i w przeszłości (11,3% vs. 18,4% i 10,8% vs. 12,3%) oraz chorób naczyń obwodowych (1,2% vs. 1,4%).
Tabela 1. Charakterystyka wyjściowa badanej populacji z podziałem na status zakażenia COVID-19. (patrz - badanie)
W okresie objętym badaniem w kohorcie COVID-19 wykryto 9 przypadków zapalenia mięśnia sercowego i 11 przypadków zapalenia osierdzia (tab. 2). W kohorcie kontrolnej wykryto 27 przypadków zapalenia mięśnia sercowego i 52 przypadki zapalenia osierdzia. Dwóch z dziewięciu pacjentów z zapaleniem mięśnia sercowego było hospitalizowanych z powodu ciężkiego zakażenia wirusem COVID-19 i wymagało wentylacji mechanicznej, a zapalenie mięśnia sercowego rozpoznano podczas hospitalizacji z powodu COVID-19, odpowiednio w 19 i 37 dniu po zakażeniu. Żaden z pacjentów, u których rozpoznano zapalenie osierdzia, nie był hospitalizowany z powodu zakażenia wirusem COVID-19. Mediana (IQR) czasu trwania hospitalizacji po zapaleniu mięśnia sercowego w kohorcie COVID-19 wynosiła 5 (2-25) dni w porównaniu z 3 (3-5) dniami w kohorcie kontrolnej (p = 0,291). Mediana (IQR) czasu hospitalizacji w następstwie zapalenia osierdzia wynosiła 2 (2-3,5) dni w kohorcie COVID-19 i 3 (1,8-5,3) dni w kohorcie kontrolnej (p = 0,272).
Tabela 2. Charakterystyka wyjściowa pacjentów z zapaleniem mięśnia sercowego i osierdzia w kohorcie COVID i bez kohorty COVID. (patrz - badanie)
Nie zaobserwowano statystycznej różnicy w częstości występowania zapalenia mięśnia sercowego (p =1) i osierdzia (p =0,17) między kohortą COVID-19 a kohortą kontrolną (ryc. 2).
Rycina 2. Szacunki Kaplana-Meiera dotyczące skumulowanego prawdopodobieństwa wystąpienia zapalenia mięśnia sercowego (A) i zapalenia osierdzia (B) w kohorcie COVID-19 i kohorcie kontrolnej w ciągu 6 miesięcy. (patrz - badanie)
W wieloczynnikowym modelu regresji proporcjonalnych zagrożeń Coxa (Tabela 3, Tabele S2 i S3), wiek (aHR 0,96; 95% CI 0,93 do 1,00, p = 0,045) i płeć męska (aHR 4,42; 95% CI 1,64 do 11,96, p = 0,003) były niezależnie związane z zapaleniem mięśnia sercowego. Otyłość była w niewielkim stopniu związana z zapaleniem mięśnia sercowego (aHR 2,31; 95% CI 0,99 do 5,41, p = 0,053). Zakażenie po zakażeniu COVID-19 nie było związane z zapaleniem mięśnia sercowego (aHR 1,08; 95% CI 0,45 do 2,56, p = 0,869).
Tabela 3. Skorygowane HR dla zapalenia mięśnia sercowego i osierdzia. (patrz - badanie)
Płeć męska (aHR 1,93; 95% CI 1,09 do 3,41, p = 0,025) i choroba naczyń obwodowych (aHR 4,20; 95% CI 1,50 do 11,72, p = 0,006) były związane z zapaleniem osierdzia (Tabela 3). Zakażenie po zakażeniu COVID-19 nie było związane z zapaleniem osierdzia (aHR 0,53; 95% CI 0,25 do 1,13, p = 0,1).
4. Dyskusja
W obecnym dużym badaniu populacyjnym osób, które nie były szczepione przeciwko SARS-CoV-2, nie zaobserwowano zwiększenia częstości występowania zapalenia mięśnia sercowego ani zapalenia osierdzia od 10. dnia po uzyskaniu dodatniego wyniku na obecność SARS-CoV-2.
Analiza wielozmiennowa wykazała, że płeć męska wiąże się z większym ryzykiem rozwoju zapalenia mięśnia sercowego lub osierdzia, niezależnie od wcześniejszego zakażenia COVID-19.
Zakażenie wirusem COVID-19 jest przyczyną znacznej zachorowalności i śmiertelności na niespotykaną dotąd skalę w skali globalnej. Gromadzone są coraz liczniejsze dane naukowe i kliniczne dotyczące podostrych i długoterminowych skutków zakażenia wirusem COVID-19, które mogą dotyczyć wielu układów narządowych. Najnowsze badania sugerują kilka mechanizmów patogenezy uporczywych i długotrwałych objawów związanych z układem sercowo-naczyniowym.
W kilku wcześniejszych badaniach nad zakażeniami SARS-CoV zwrócono uwagę na możliwy związek między rodzajami zakażeń koronawirusami a reakcjami immunologicznymi [14,15].
Przeciwciała przeciwko koronawirusom-OC43 i 229E stwierdzono u pacjentów, u których zdiagnozowano stwardnienie rozsiane [16]. Wysokie i trwałe poziomy autoprzeciwciał przeciw erytrocytom stwierdzono u myszy zakażonych koronawirusem murine hepatitis [17].
Biorąc pod uwagę kliniczne podobieństwa między SARS-CoV-2 a innymi koronawirusami [18,19], można sobie wyobrazić, że uszkodzenie tkanek na drodze immunologicznej jest również potencjalnie wywoływane przez zakażenie SARS-CoV-2. Mimikra molekularna, aktywacja swoistych limfocytów T do zmienionych przez wirusa autoprotein i aktywacja limfocytów B to kilka przykładów mechanizmów pośredniczących w potencjalnym wystąpieniu zapalenia mięśnia sercowego i osierdzia, które mogą odgrywać rolę w wywoływaniu opóźnionego zapalenia serca [9]. Ponadto, w ostatnim badaniu 309 pacjentów z COVID-19 zostało przebadanych na obecność sześciu różnych autoprzeciwciał, takich jak przeciwciała przeciwjądrowe i przeciwciała przeciwko interferonowi-α2, co najmniej dwa miesiące po początkowym zachorowaniu. W tym badaniu autoprzeciwciała były związane z większym ryzykiem rozwoju ostrych następstw COVID-19 [20].
Na początku pandemii COVID-19 okazało się, że pacjenci z COVID-19 z chorobami współistniejącymi w układzie sercowo-naczyniowym mają gorsze rokowanie i większą śmiertelność wewnątrzszpitalną [21]. Osoby z chorobami autoimmunologicznymi wydają się być szczególnie narażone na ciężkie następstwa zakażenia wirusem COVID-19 [22]. W innych badaniach wykazano, że ciężka postać choroby COVID-19 wiąże się z silną reakcją zapalną, w tym z reakcją nadwrażliwości typu drugiego i czwartego, wynikającą z nadmiernej aktywacji limfocytów T i następującej po niej burzy cytokinowej [23,24]. Objawy COVID-19 o podłożu immunologicznym obejmują naśladowanie chorób autoimmunologicznych, takich jak choroba Kawasaki, zespół Guillain-Barre, zapalenie naczyń, zapalenie mięśni i uszkodzenie mięśnia sercowego [25].
Puntmann i wsp. stwierdzili 78-procentowe zajęcie serca oceniane za pomocą rezonansu magnetycznego serca (MRI) wśród pacjentów z potwierdzonym rozpoznaniem COVID-19 osiem tygodni przed włączeniem do badania [26], z których większość była bezobjawowa lub miała jedynie łagodne objawy. W badaniu tym wykazano, że zapalenie mięśnia sercowego jest niezależne od ciężkości choroby wyjściowej ani od ogólnego przebiegu ostrej choroby. W niedawno przeprowadzonym badaniu wykazano zwiększone ryzyko późnych powikłań sercowo-naczyniowych zarówno w przypadku objawowego, jak i bezobjawowego zakażenia SARS-CoV-2 [27]. Dlatego też staraliśmy się również zbadać, czy uszkodzenie serca może wystąpić niezależnie od obecności objawów związanych z chorobą wieńcową. Dodatkowym potwierdzeniem potencjalnego późnego zapalnego zajęcia osierdzia i mięśnia sercowego jest dodatkowe badanie z zastosowaniem rezonansu magnetycznego (CMR), w którym wykazano obrzęk mięśnia sercowego, zwłóknienie i upośledzenie funkcji prawej komory u 58% (16 z 25) pacjentów, którzy niedawno powrócili do zdrowia po zakażeniu COVID-19 [28]. Badania te są wspierane przez badania autopsyjne wskazujące na występowanie nacieków jednojądrowych u pacjentów z zakażeniem COVID-19 [29]. Istotnym zastrzeżeniem tych badań jest jednak brak odpowiedniej kontroli, w tym pacjentów z innymi współistniejącymi zakażeniami wirusowymi.
Podobnie jak w naszym badaniu, Xie i wsp. wykazali, że u osób z zakażeniem COVID-19 istnieje zwiększone ryzyko powikłań sercowo-naczyniowych 30 dni po zakażeniu, w tym zapalenia osierdzia i mięśnia sercowego, niezależnie od konieczności hospitalizacji [30]. Podobnie jak w naszym badaniu, badana populacja była testowana pod kątem ryzyka zapalnych chorób serca niezależnie od wcześniejszego szczepienia SRAS-COV-2. Jednak w przeciwieństwie do badania Xie i wsp. badana kohorta była jednorodna, składająca się z osób z Departamentu Spraw Weteranów USA, z przewagą mężczyzn i w młodym wieku. Różnica w charakterystyce populacji może tłumaczyć rozbieżność między wynikami badań, ponieważ wiadomo, że młodzi mężczyźni częściej zapadają na zapalenie mięśnia sercowego i osierdzia.
Wyższe ryzyko zapalenia mięśnia sercowego (wskaźnik ryzyka, 18,28; 95% CI, 3,95 do 25,12; różnica ryzyka, 11,0 zdarzeń na 100 000 osób; 95% CI, 5,6 do 15,8) i zapalenia osierdzia zaobserwowano w dużym badaniu populacyjnym opublikowanym niedawno przez Barda i wsp. Chociaż zarówno nasze badanie, jak i badanie Barda i wsp. opierają się na pacjentach Clalit Health Service, istnieje kilka istotnych różnic między tymi badaniami. Barda i wsp. koncentrowali się na szczepieniach przeciwko COVID-19, a zatem ich dopasowanie miało na celu neutralizację czynników związanych ze szczepieniem, podczas gdy nasze badanie dotyczy populacji nieszczepionej. Barda i wsp. badali występowanie zapalenia mięśnia sercowego i osierdzia od dodatnich wyników PCR do 42 dni, podczas gdy my badamy pacjentów powracających do zdrowia od 10 dni po zakażeniu i przez znacznie dłuższy czas. Analiza Bardy i wsp. nie uwzględnia również czasu wystąpienia zapalenia mięśnia sercowego i osierdzia. Wreszcie, podczas gdy Barda i wsp. uwzględnili wiele przyczyn zapalenia mięśnia sercowego i osierdzia, my uwzględniliśmy tylko ostre zapalenie mięśnia sercowego i osierdzia u pacjentów hospitalizowanych, co jest bardziej prawdopodobne.
Nasze obecne badanie ma kilka ograniczeń. Po pierwsze, choć potencjalna liczba uczestników, którzy mogli być włączeni do badania, była duża, liczba przypadków zapalenia mięśnia sercowego i osierdzia była niewielka. Wynikało to głównie z ograniczenia, jakim był stosunkowo krótki okres obserwacji, spowodowany rozpoczęciem programu masowych szczepień. Po drugie, uwzględniliśmy tylko przypadki hospitalizowanych pacjentów z zapaleniem mięśnia sercowego lub osierdzia, podczas gdy z badania wyłączono ambulatoryjną dokumentację medyczną. Mogło to spowodować pominięcie niewielkiej liczby pacjentów z łagodną postacią choroby. Ponadto uwzględniliśmy rozpoznanie zapalenia mięśnia sercowego i osierdzia na podstawie dokumentacji medycznej, bez dostępu do informacji dotyczących potwierdzenia rozpoznania przez pacjenta.
5. Wnioski
Nasze dane sugerują, że nie ma wzrostu częstości występowania zapalenia mięśnia sercowego i osierdzia u pacjentów zakażonych COVID-19 w porównaniu z niezakażonymi, dobranymi kontrolami. Konieczne będą dalsze, długoterminowe badania w celu oszacowania częstości występowania zapalenia osierdzia i mięśnia sercowego u pacjentów, u których rozpoznano COVID-19.
Opracowała: lek.Ewelina Gierszewska
Odnośniki:
- Paules, C.I.; Marston, H.D.; Fauci, A.S. Coronavirus Infections-More Than Just the Common Cold. JAMA 2020, 323, 707-708. [Google Scholar] [CrossRef] [PubMed]
- Lopez-Leon, S.; Wegman-Ostrosky, T.; Perelman, C.; Sepulveda, R.; Rebolledo, P.A.; Cuapio, A.; Villapol, S. More than 50 long-term effects of COVID-19: A systematic review and meta-analysis. Sci. Rep. 2021, 11, 16144. [Google Scholar] [CrossRef] [PubMed]
- Raveendran, A.V.; Jayadevan, R.; Sashidharan, S. Long COVID: An overview. Diabetes Metab. Syndr. Clin. Res. Rev. 2021, 15, 869-875. [Google Scholar] [CrossRef] [PubMed]
- Shuwa, H.A.; Shaw, T.N.; Knight, S.B.; Wemyss, K.; McClure, F.A.; Pearmain, L.; Prise, I.; Jagger, C.; Morgan, D.J.; Khan, S.; et al. Alterations in T and B cell function persist in convalescent COVID-19 patients. Med 2021, 2, 720-735.e4. [Google Scholar] [CrossRef] [PubMed]
- McElvaney, O.J.; McEvoy, N.L.; McElvaney, O.F.; Carroll, T.P.; Murphy, M.P.; Dunlea, D.M.; Ni Choileain, O.; Clarke, J.; O’Connor, E.; Hogan, G.; et al. Characterization of the Inflammatory Response to Severe COVID-19 Illness. Am. J. Respir. Crit. Care Med. 2020, 202, 812-821. [Google Scholar] [CrossRef]
- Tang, N.; Li, D.; Wang, X.; Sun, Z. Abnormal Coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Thromb. Haemost. 2020, 18, 844-847. [Google Scholar] [CrossRef]
- Ercolini, A.M.; Miller, S.D. The role of infections in autoimmune disease. Clin. Exp. Immunol. 2009, 155, 1-15. [Google Scholar] [CrossRef]
- Yazdanpanah, N.; Rezaei, N. Autoimmune complications of COVID-19. J. Med. Virol. 2021, 94, 54-62. [Google Scholar] [CrossRef]
- Fujinami, R.S.; von Herrath, M.G.; Christen, U.; Whitton, J.L. Molecular Mimicry, Bystander Activation, or Viral Persistence: Infections and Autoimmune Disease. Clin. Microbiol. Rev. 2006, 19, 80-94. [Google Scholar] [CrossRef]
- Caforio, A.L.P.; Mahon, N.; Baig, M.K.; Tona, F.; Murphy, R.T.; Elliott, P.M.; McKenna, W.J. Prospective Familial Assessment in Dilated Cardiomyopathy: Cardiac autoantibodies predict disease development in asymptomatic relatives. Circulation 2007, 115, 76-83. [Google Scholar] [CrossRef]
- Matsui, S.; Fu, M.L.; Katsuda, S.; Hayase, M.; Yamaguchi, N.; Teraoka, K.; Kurihara, T.; Takekoshi, N.; Murakami, E.; Hoebeke, J.; et al. Peptides Derived from Cardiovascular G-protein-coupled Receptors Induce Morphological Cardiomyopathic Changes in Immunized Rabbits. J. Mol. Cell. Cardiol. 1997, 29, 641-655. [Google Scholar] [CrossRef] [PubMed]
- Barda, N.; Dagan, N.; Ben-Shlomo, Y.; Kepten, E.; Waxman, J.; Ohana, R.; Hernán, M.A.; Lipsitch, M.; Kohane, I.; Netzer, D.; et al. Safety of the BNT162b2 mRNA COVID-19 Vaccine in a Nationwide Setting. N. Engl. J. Med. 2021, 385, 1078-1090. [Google Scholar] [CrossRef] [PubMed]
- Marom, T.; Tshori, S.; Shefer, G.; Pitaro, J. Pneumococcal Conjugated Vaccines Decreased Acute Otitis Media Burden: A Population-Based Study in Israel. J. Pediatr. 2021, 235, 233-238.e3. [Google Scholar] [CrossRef] [PubMed]
- Lo, A.W.; Tang, N.L.; To, K.-F. How the SARS coronavirus causes disease: Host or organism? J. Pathol. 2006, 208, 142-151. [Google Scholar] [CrossRef] [PubMed]
- Kyuwa, S.; Yamaguchi, K.; Toyoda, Y.; Fujiwara, K. Induction of self-reactive T cells after murine coronavirus infection. J. Virol. 1991, 65, 1789-1795. [Google Scholar] [CrossRef] [PubMed]
- Salmi, A.; Ziola, B.; Hovi, T.; Reunanen, M. Antibodies to coronaviruses OC43 and 229E in multiple sclerosis patients. Neurology 1982, 32, 292-295. [Google Scholar] [CrossRef]
- Lardans, V.; Godfraind, C.; Van Der Logt, J.T.M.; Heessen, F.W.A.; Gonzalez, M.-D.; Coutelier, J.-P. Polyclonal B lymphocyte activation induced by mouse hepatitis virus A59 infection. J. Gen. Virol. 1996, 77, 1005-1009. [Google Scholar] [CrossRef]
- Lu, R.; Zhao, X.; Li, J.; Niu, P.; Yang, B.; Wu, H.; Wang, W.; Song, H.; Huang, B.; Zhu, N.; et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and receptor binding. Lancet 2020, 395, 565-574. [Google Scholar] [CrossRef]
- Le Bert, N.; Tan, A.T.; Kunasegaran, K.; Tham, C.Y.L.; Hafezi, M.; Chia, A.; Chng, M.H.Y.; Lin, M.; Tan, N.; Linster, M.; et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 2020, 584, 457-462. [Google Scholar] [CrossRef]
- Su, Y.; Yuan, D.; Chen, D.G.; Ng, R.H.; Wang, K.; Choi, J.; Li, S.; Hong, S.; Zhang, R.; Xie, J.; et al. Multiple early factors anticipate post-acute COVID-19 sequelae. Cell 2022, 185, 881-895.e20. [Google Scholar] [CrossRef]
- Late-Breaking Science Abstracts and Featured Science Abstracts From the American Heart Association’s Scientific Sessions 2020 and Late-Breaking Abstracts in Resuscitation Science From the Resuscitation Science Symposium 2020. Circulation 2020, 142, e470-e500. [CrossRef]
- Montero, F.; Martínez-Barrio, J.; Serrano-Benavente, B.; González, T.; Rivera, J.; Collada, J.M.; Castrejón, I.; Álvaro-Gracia, J. Coronavirus disease 2019 (COVID-19) in autoimmune and inflammatory conditions: Clinical characteristics of poor outcomes. Rheumatol. Int. 2020, 40, 1593-1598. [Google Scholar] [CrossRef]
- Tan, C.; Zheng, X.; Sun, F.; He, J.; Shi, H.; Chen, M.; Tu, C.; Huang, Y.; Wang, Z.; Liang, Y.; et al. Hypersensitivity may be involved in severe COVID-19. Clin. Exp. Allergy 2021, 52, 324-333. [Google Scholar] [CrossRef] [PubMed]
- Yu, L.; Feng, Z. The Role of Toll-Like Receptor Signaling in the Progression of Heart Failure. Mediat. Inflamm. 2018, 2018, 9874109. [Google Scholar] [CrossRef] [PubMed]
- Saad, M.A.; Alfishawy, M.; Nassar, M.; Mohamed, M.; Esene, I.N.; Elbendary, A. COVID-19 and Autoimmune Diseases: A Systematic Review of Reported Cases. Curr. Rheumatol. Rev. 2021, 17, 193-204. [Google Scholar] [CrossRef]
- Puntmann, V.O.; Carerj, M.L.; Wieters, I.; Fahim, M.; Arendt, C.; Hoffmann, J.; Shchendrygina, A.; Escher, F.; Vasa-Nicotera, M.; Zeiher, A.M.; et al. Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020, 5, 1265-1273. [Google Scholar] [CrossRef]
- Tereshchenko, L.G.; Bishop, A.; Fisher-Campbell, N.; Levene, J.; Morris, C.; Patel, H.; Khan, A. Risk of Cardiovascular Events after COVID-19: A double-cohort study. medRxiv 2021. [Google Scholar] [CrossRef]
- Huang, L.; Zhao, P.; Tang, D.; Zhu, T.; Han, R.; Zhan, C.; Liu, W.; Zeng, H.; Tao, Q.; Xia, L. Cardiac Involvement in Patients Recovered From COVID-2019 Identified Using Magnetic Resonance Imaging. JACC Cardiovasc. Imaging 2020, 13, 2330-2339. [Google Scholar] [CrossRef]
- Rali, A.S.; Ranka, S.; Shah, Z.; Sauer, A.J. Mechanisms of Myocardial Injury in Coronavirus Disease 2019. Card. Fail. Rev. 2020, 6, e15. [Google Scholar] [CrossRef]
- Xie, Y.; Xu, E.; Bowe, B.; Al-Aly, Z. Long-term cardiovascular outcomes of COVID-19. Nat. Med. 2022, 28, 583-590. [Google Scholar] [CrossRef]






